Glosario
Glosario
A
Acido desoxirribonucleico (ADN)
Acido desoxirribonucleico (ADN)
En el corazón de la biología, un intrincado código molecular revela los
secretos más íntimos de la vida misma: el ácido desoxirribonucleico, más conocido
como ADN. En su anatomía, este ácido nucleico se despliega como una escalera de
doble hélice. Lo que hace que el ADN sea verdaderamente asombroso es su
capacidad para almacenar información a una escala casi inimaginable. En cada
célula de nuestro cuerpo, se encuentran miles de millones de nucleótidos, dispuestos
en una secuencia única que codifica la esencia misma de lo que somos. Pero el ADN
es mucho más que un simple almacén de datos; es un arquitecto magistral que guía
el desarrollo y la función de cada ser vivo. Su estructura en doble hélice garantiza
una estabilidad excepcional, mientras que su capacidad para replicarse con precisión
milimétrica asegura la continuidad de la vida a lo largo de las generaciones.
Las aplicaciones del ADN son tan vastas como el universo mismo. En el
campo de la medicina, por ejemplo, la secuenciación del ADN ha abierto las puertas
a un nuevo mundo de diagnóstico y tratamiento personalizado, permitiendo a los
médicos abordar enfermedades de una manera nunca antes imaginada.
Acido nucleico
Acido nucleico
acido nucleico
MaternidadEn los confines íntimos de nuestras células, reside un código que trasciende los límites del tiempo y el espacio: el ácido nucleico. Esta molécula maestra actúa como el archivo codificado que almacena y transmite la información genética vital para la herencia y la expresión de los rasgos biológicos. En su construcción básica, el ácido nucleico se compone de unidades fundamentales conocidas como nucleótidos, que se ensamblan en una estructura helicoidal en espiral, como una escalera retorcida que se despliega dentro del núcleo celular.
Lo que hace que el ácido nucleico sea verdaderamente extraordinario es su capacidad para almacenar una cantidad asombrosa de información en un espacio microscópico. Además, su estructura modular no solo es la base de la evolución al permitir una gran diversidad y variabilidad genética, sino que también, actúa como un guardián infalible de la continuidad de la vida a lo largo de las generaciones. Ya sea en forma de ADN (ácido desoxirribonucleico) o ARN (ácido ribonucleico), exhibe una notable estabilidad y fidelidad en la transmisión de información.
¿Sabías que el ADN humano, si se extendiera linealmente, podría llegar a la luna y volver más de 6000 veces? Desde los misterios de la herencia hasta las fronteras inexploradas de la ingeniería genética, el ácido nucleico sigue siendo un testamento perdurable al poder y la maravilla de la biología.
Acido ribonucleico (ARN)
Acido ribonucleico (ARN)
El ácido ribonucleico (ARN) es como el interlocutor que lleva las órdenes del
ADN y coordina las acciones de la célula. Es una molécula que desciende del ADN y
que comparte información genética crucial para la vida. Aunque suele vivir a la
sombra del ADN, el ARN desempeña papeles protagonistas en la célula, permitiendo
que las instrucciones genéticas se conviertan en acción.
A diferencia del ADN, es más común que el ácido ribonucleico exista en
forma de una sola cadena. Otra diferencia a destacar, es que el ARN no es una
molécula uniforme. Existen varios tipos de ARN, incluyendo el ARN mensajero
(ARNm) que lleva las instrucciones del ADN a las ribosomas, el ARN ribosómico
(ARNr) que forma parte de la maquinaria de síntesis de proteínas, y el ARN de
transferencia (ARNt) que lleva los aminoácidos al ribosoma para la construcción de
proteínas.
Una característica muy importante que lo define es la temporalidad. El ARN es
una molécula temporal, en constante creación y degradación. Esto le permite a la
célula adaptarse rápidamente a las necesidades cambiantes.
Esta molécula es clave en diversas áreas de la biología y la medicina. Algunos
ejemplos de aplicación son las vacunas de ARN (como las vacunas contra el
COVID-19) y su uso en terapia génica, ya que se investiga su utilización para corregir
mutaciones genéticas y tratar enfermedades hereditarias.


Adenina
Adenina
La adenina es una de las cuatro bases nitrogenadas que conforman el ADN, la
molécula de la herencia. Podemos imaginar al ADN como un libro gigante donde se
escriben las instrucciones de la vida, y la adenina es una de las letras que forman
ese libro, junto con sus compañeras guanina (G), citosina (C) y timina (T) ¡Cada uno
de nosotros tiene una biblioteca genética única!
Podemos pensar que la adenina es como una pieza de Lego en el ADN. Se
empareja con la timina en una relación perfecta, mientras que la guanina se une a la
citosina. Este emparejamiento es crucial para la replicación del ADN, el proceso por
el cual nuestras células se duplican para crecer y repararse. Además, es importante
destacar que, la adenina no solo es una pieza de ADN, sino que también, es parte
fundamental de algo llamado ATP, o trifosfato de adenosina, ¿Te suena familiar, no?.
El ATP es la moneda energética de nuestras células. Cuando necesitas mover un
músculo, pensar o incluso parpadear, estás utilizando el ATP, y la adenina es un
componente clave en su estructura.


ADN mitocondrial
ADN mitocondrial
El ADN mitocondrial es una forma especial de ADN que se encuentra en las
mitocondrias, es decir, en aquellas organelas que funcionan como las pequeñas
centrales de energía en nuestras células. A diferencia del ADN nuclear, que
heredamos de ambos padres, el ADN mitocondrial se hereda exclusivamente a
través de la madre, estableciendo así una conexión hereditaria singular, conocida
como “herencia materna”. Esta característica lo convierte en un rastreador de linaje
materno excepcional, como un testigo molecular de la historia familiar.
Ahora bien, ¿por qué es tan interesante? El ADN mitocondrial es una molécula
muy antigua que alberga información clave sobre nuestra ascendencia. Se cree que
todos los seres humanos comparten un ancestro común en un punto remoto de la
historia.
Desde una perspectiva profesional de la salud, el ADN mitocondrial tiene
aplicaciones relevantes. Se utiliza, por ejemplo, en medicina forense para identificar
restos humanos y establecer relaciones familiares. Además, su estudio es
fundamental en el diagnóstico de enfermedades mitocondriales, como por ejemplo, el
Síndrome de Leigh.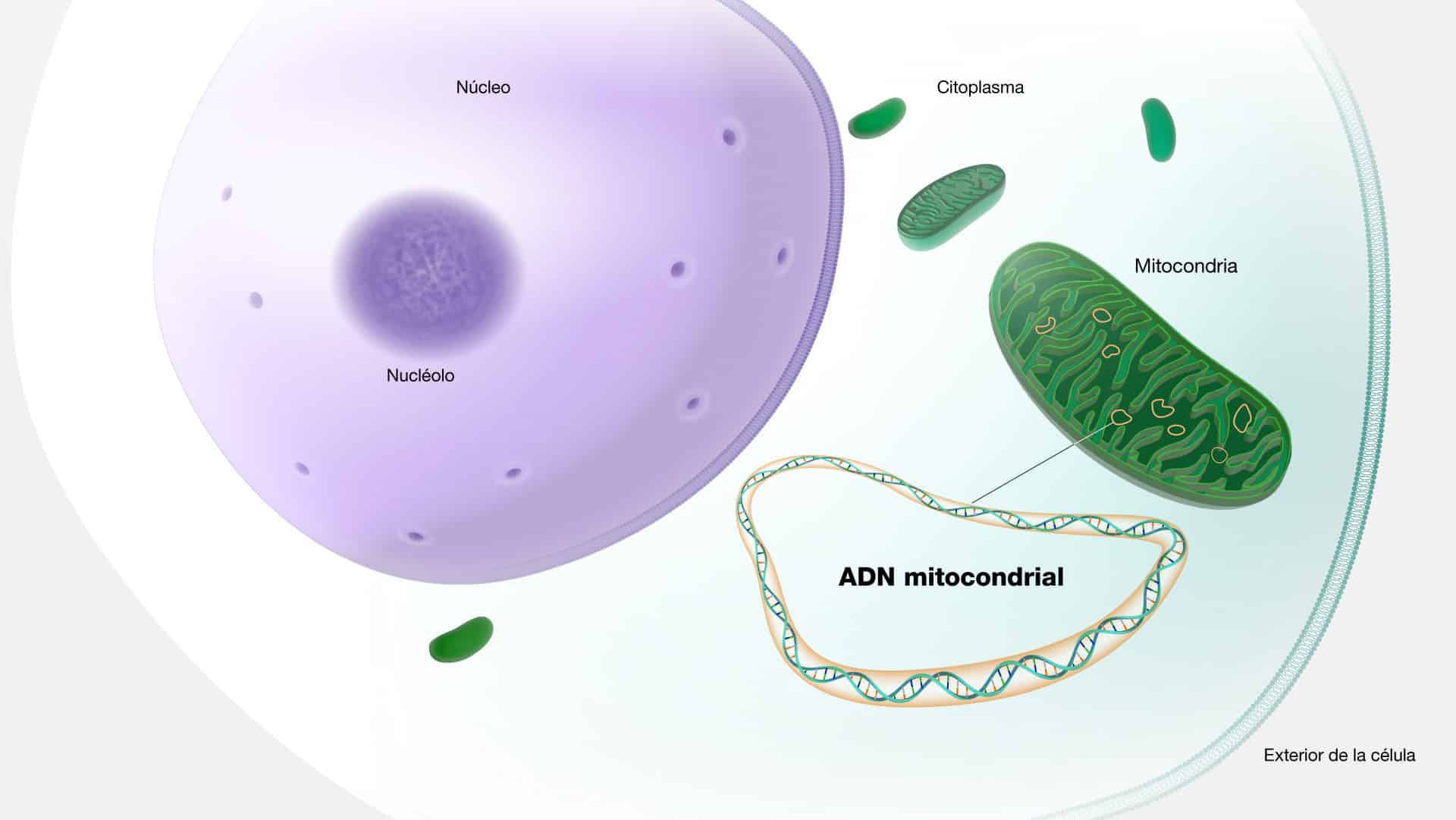

ADN no codificante
ADN no codificante
El ADN no codificante, era conocido como ADN basura en el pasado, ¡pero
qué lejos estamos de considerarlo basura hoy en día! Es un componente de nuestro
genoma que no contiene instrucciones directas para la síntesis de proteínas. A
diferencia de las regiones codificantes, que son como destellos brillantes en el cielo
nocturno de la genética, estas regiones permanecen en las sombras, aparentemente
silenciosas y sin función visible.
Lo que hace que el ADN no codificante sea tan intrigante es su aparente falta
de propósito obvio. Sin embargo, a medida que profundizamos en su estudio,
descubrimos que estas regiones misteriosas están lejos de ser inútiles. Por el
contrario, desempeñan roles cruciales en la regulación de la expresión génica, el
mantenimiento de la integridad estructural del cromosoma e incluso en la evolución
misma.
¿Sabías que más del 98% del genoma humano se compone de ADN no
codificante? Este inmenso océano de secuencias misteriosas alberga un potencial
inexplorado que podría revelar secretos fundamentales sobre la naturaleza de la vida
misma. Además, se ha descubierto que ciertas secuencias de ADN no codificante se
conservan a lo largo de la evolución, sugiriendo que desempeñan roles críticos en la
función biológica que aún no comprendemos completamente.
ADN recombinante (rADN)
ADN recombinante (rADN)
El ADN recombinante (rADN) es una técnica fundamental en biología
molecular que permite la manipulación y modificación de material genético de
manera precisa. Su funcionamiento se basa en la capacidad de cortar y pegar
segmentos de ADN de diferentes fuentes para crear un nuevo ADN con
características específicas.
El ADN recombinante tiene numerosas aplicaciones en biología, medicina y
biotecnología. Algunos ejemplos notables incluyen la producción de insulina
recombinante, la obtención de proteínas terapéuticas, la ingeniería de plantas
resistentes a enfermedades y plagas, y la investigación genética para comprender y
tratar enfermedades genéticas. También se ha utilizado para desarrollar vacunas y
estudiar la función de genes específicos en organismos modelo.

Alelo
Alelo
Los alelos son variantes de un gen específico, como las distintas letras de una
palabra que cambian su significado. Estos pedazos de ADN, ubicados en el mismo
lugar del cromosoma, determinan características heredables en los seres vivos.
Cada individuo hereda dos alelos para cualquier localización genómica en la que se
observe tal variación, obteniendo uno de cada progenitor. Hay diversas
características de gran relevancia cuando hablamos de los alelos, aquí nombraremos
las tres más importantes:
1. Los alelos pueden ser dominantes o recesivos. El alelo dominante se expresa
y enmascara la presencia del recesivo. Por ejemplo, el alelo para el color de
ojos oscuros es dominante sobre el de ojos claros.
2. Homocigotos y Heterocigotos: Un organismo puede tener dos alelos iguales
(homocigoto) o dos diferentes (heterocigoto) para un gen. Esta combinación
determina cómo se manifiesta la característica.
3. Alelos Múltiples: Algunos genes tienen más de dos alelos en una población,
como el grupo sanguíneo humano (A, B, AB, O). Esta diversidad genética es
clave en la adaptación y la evolución.
Los alelos son fundamentales en la genética y tienen aplicaciones
asombrosas. En el caso de la medicina personalizada los alelos pueden revelar
predisposiciones genéticas a enfermedades (por ejemplo, el gen BRCA1 está
relacionado con el riesgo de cáncer de mama); por otro lado, tenemos el ejemplo de
la agricultura, en la que la ingeniería genética utiliza alelos para desarrollar cultivos
resistentes a plagas o para obtener mayor rendimiento.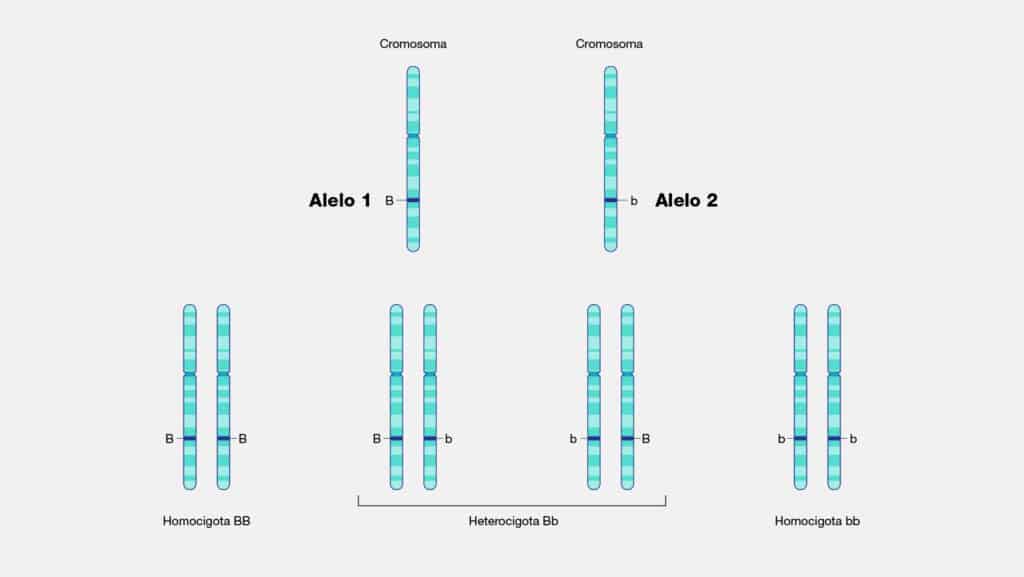

Aminoacido
Aminoacido
Los aminoácidos son los componentes básicos de las proteínas. La
combinación de estos aminoácidos en cadenas largas y específicas es lo que crea la
diversidad de proteínas que forman nuestro ser. Se reconocen 20 aminoácidos
únicos. Una proteína se compone de dos o más cadenas de aminoácidos, conocidas
como polipéptidos, cuya secuencia está codificada en un gen. Mientras que el
organismo puede sintetizar algunos aminoácidos internamente, existen otros,
denominados aminoácidos esenciales, que deben ser adquiridos a través de la dieta.
Los aminoácidos poseen estructura versátil, es decir, cuentan con una
estructura central que incluye un grupo amino, un grupo carboxilo y una cadena
lateral única que les da sus propiedades específicas y determina la función de la
proteína.
Una de las características más interesantes de estas moléculas reside en el
concepto de código genético. El ADN lleva la información que determina la secuencia
de aminoácidos en una proteína. Cada grupo de tres letras en el código genético,
conocido como codón, representa un aminoácido específico.
Los aminoácidos no son solo elementos de la biología, sino que también
tienen aplicaciones prácticas asombrosas, como los suplementos nutricionales, en la
industria farmacéutica o en la cosmética, donde forman parte de diversos productos
para el cuidado de la piel y el cabello.
Ejemplo de aminoácidos esenciales:
● Leucina: cuya función es importante para el crecimiento y la regeneración
muscular.
● Treonina: contribuye a la formación de colágeno, elastina y tejido muscular.
Ejemplo de aminoácidos no esenciales:
● Alanina: Participa en la producción de glucosa y energía.
● Serina: Participa en la síntesis de purinas y pirimidinas, componentes de los
ácidos nucleicos.


Amplificacion genetica
Amplificacion genetica
La amplificación genética es una herramienta que nos permite multiplicar
copias específicas de una secuencia de ADN, como si reprodujéramos un fragmento
de música una y otra vez. Esto es crucial en la investigación y diagnóstico molecular,
ya que a menudo solo tenemos pequeñas muestras de ADN para trabajar.
Este término también se vincula estrechamente con una técnica de laboratorio
conocida como reacción en cadena de la polimerasa (PCR, por sus siglas en inglés).
Esta técnica utiliza una enzima especial llamada ADN polimerasa para copiar una
secuencia específica de ADN en una reacción en cadena, creando millones de
copias de la misma. Existen dos características fundamentales que resumen a la
PCR: la temperatura extrema, dado que involucra ciclos de calor y enfriamiento, lo
que permite que la enzima ADN polimerasa funcione a temperaturas óptimas; y la
amplificación selectiva, ya que permite amplificar solo las secuencias de interés.
La amplificación genética ha revolucionado la biología y ha encontrado
aplicaciones en diversos campos como la medicina molecular, las ciencias forenses y
el estudio de identificación de especies.

Analisis de deteccion de portadores
Analisis de deteccion de portadores
El análisis de portador, es una herramienta que nos permite desentrañar los
secretos genéticos que cargamos en nuestras células, es como un faro que nos
orienta en el inmenso mar de la genética. Esta técnica se utiliza para identificar a las
personas que son portadores de una mutación genética específica, pero que no
muestran síntomas de la enfermedad asociada. Es como llevar en nuestro código
genético un mensaje oculto, un gen alterado que solo se manifiesta si ambos padres
transmiten la misma mutación a su descendencia. Entonces, los portadores de una
mutación genética son individuos que llevan una copia normal y una copia mutada de
un gen específico, y no presentan los síntomas de la enfermedad, ya que la copia
normal suele ser suficiente para un funcionamiento saludable.
La mayoría de las enfermedades que se evalúan mediante el análisis de
portador siguen un patrón de herencia autosómica recesiva, lo que significa que
ambas copias del gen deben ser mutadas para que la enfermedad se manifieste en
la descendencia.
Ejemplo: supongamos que una pareja está considerando tener hijos y decide
someterse a pruebas genéticas para la detección de portadores. Descubren que
ambos son portadores de un alelo variante de un gen asociado con la fibrosis
quística, una enfermedad hereditaria recesiva. Aunque ninguno de los padres tiene
síntomas de la enfermedad, existe un riesgo de que sus hijos la desarrollen si
heredan ambas variantes de los padres. Este conocimiento les permite tomar
decisiones informadas sobre su planificación familiar y considerar opciones como la
reproducción asistida y la selección de embriones.


Anticodon
Anticodon
El anticodón, ese trío de letras en el lenguaje universal del ADN y el ARN que
actúa como el traductor infalible en el proceso de la síntesis de proteínas, es una de
las piezas maestras de la biología molecular. El anticodón es una secuencia de tres
nucleótidos en una molécula de ARN de transferencia (ARNt), que se une de manera
complementaria a una secuencia específica de tres nucleótidos en el ARN mensajero
(ARNm). Su función principal es decodificar el contenido del mensaje en el ARNm y
seleccionar el aminoácido correcto para ensamblar una proteína durante la
traducción.
Sus características más importantes son la especificidad, dado que cada
anticodón es altamente específico y se empareja de manera complementaria con un
codón correspondiente en el ARNm; y su flexibilidad, ya que un ARNt puede llevar
diferentes aminoácidos, dependiendo de la secuencia de su anticodón y, por lo tanto,
adaptarse a una amplia gama de secuencias de codones en el ARNm.


Antisentido
Antisentido
El antisentido, también conocido como la hebra antisentido o hebra
complementaria, es la secuencia de ADN que es la "hermana espejo" de la hebra
codificante convencional. Mientras que la hebra codificante contiene las instrucciones
para la síntesis de proteínas, el antisentido es su contraparte complementaria,
actuando como un duplicado en sentido inverso. Esta complementariedad permite
que ambas hebras se unan de manera específica. Por ejemplo, si la secuencia de la
hebra codificante es "ATCG", la del antisentido será "TAGC".
La hebra antisentido desempeña un papel crucial durante la síntesis del ARN,
dado que, las proteínas encargadas de este proceso leen la hebra antisentido para
generar una hebra sentido del ARNm, es decir, la complementaria que coincide con
la codificante. Además, tiene un rol fundamental en la regulación de la expresión
génica; puede unirse a la hebra codificante y formar estructuras de doble cadena,
impidiendo la lectura de la información genética o promoviendo su degradación.
El uso de ADN antisentido se ha convertido en una herramienta valiosa en la
biología molecular y la medicina. Algunos ejemplos notables de su aplicación
incluyen su empleo en investigación de terapia génica y en el desarrollo de fármacos
que regulen la expresión génica, lo que podría conducir a tratamientos más precisos y personalizados.


ARN de transferencia (ARNt)
ARN de transferencia (ARNt)
El ARN de transferencia (ARNt) es como un mensajero minucioso que lleva
los bloques de construcción precisos para ensamblar nuestras proteínas. Es una
molécula esencial que actúa como un adaptador en el proceso de traducción
genética. Su función principal es llevar aminoácidos específicos al ribosoma, donde
se ensamblan en una cadena polipeptídica para formar una proteína.
El ARNt tiene una estructura tridimensional única en forma de trébol o de "L".
En su extremo 3', lleva un aminoácido específico, y en la parte inferior contiene una
secuencia de tres nucleótidos llamada anticodón, que se empareja
complementariamente con el codón en el ARNm.
Lo distinguen dos características clave: la versatilidad y la precisión. La
primera, se debe a que existen múltiples tipos de ARNt, cada uno especializado en
cargar un aminoácido particular. Esta diversidad asegura que cada aminoácido sea
entregado al ribosoma en el orden adecuado durante la síntesis de proteínas. Por
otro lado, se caracteriza por su gran precisión. La base complementaria en el
anticodón garantiza que el aminoácido correcto se una al ribosoma en respuesta a la
secuencia de codones en el ARNm. Un error en la traducción, ¡podría alterar
completamente la función de la proteína!
El ARNt desempeña un papel crucial en la célula y tiene aplicaciones
importantes en la investigación y la medicina. Tal es el caso de su aplicación en la
terapia génica, en la que se investiga su uso para restaurar la función normal celular
en pacientes con trastornos genéticos causados por defectos en esta molécula.


ARN mensajero (ARNm)
ARN mensajero (ARNm)
El ARNm es una molécula de ácido ribonucleico (ARN) que actúa como
intermediario entre el ADN y las proteínas en el proceso de síntesis proteica, también
conocido como traducción. Su función principal es llevar la información genética
desde el ADN, ubicado en el núcleo de la célula, hasta los ribosomas en el
citoplasma, donde se ensamblan las proteínas. Una vez en el citoplasma, la
maquinaria encargada de la producción de proteínas lee la secuencia del ARNm,
traduciendo cada codón en su correspondiente aminoácido. Este proceso resulta en
la formación de una cadena proteica en desarrollo.
El proceso comienza en el núcleo celular, donde la enzima ARN polimerasa
transcribe una secuencia específica de ADN en una molécula de ARNm
complementaria, proceso conocido como transcripción. Este ARNm recién
sintetizado, llamado transcrito primario, experimenta un procesamiento posterior en
el núcleo para eliminar intrones (regiones no codificantes) y unir exones (regiones
codificantes) en un ARNm maduro funcional. Una vez que el ARNm maduro está
listo, se exporta fuera del núcleo hacia el citoplasma, donde se une a los ribosomas,
para luego interactuar con el ARNt y así iniciar la síntesis de proteínas.
El ARNm tiene una estructura única que le permite codificar la secuencia de
aminoácidos de una proteína específica. Esta secuencia se lee en grupos de tres
nucleótidos llamados codones. Cada codón especifica un aminoácido particular, y el
ARNm lleva estos mensajes codificados desde el ADN hasta los ribosomas para que
se de la síntesis proteica.
En cuanto a las aplicaciones, el ARNm tiene un potencial enorme en
medicina, especialmente en el desarrollo de vacunas y terapias génicas. Además, la
tecnología de ARNm se está investigando como una herramienta prometedora para
el tratamiento de enfermedades genéticas, cáncer y otras afecciones.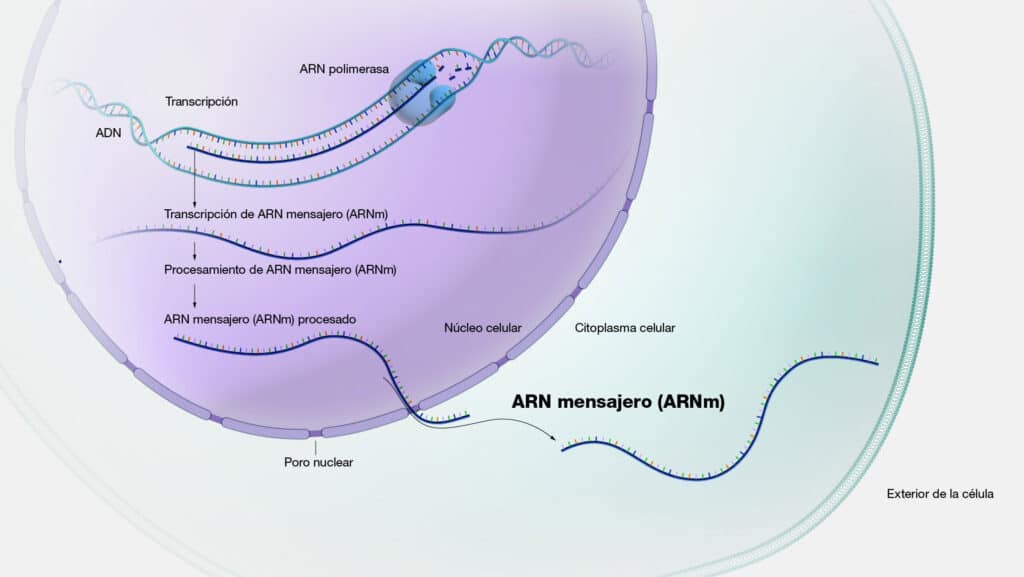

Autosoma
Autosoma
El autosoma, es como la columna vertebral que sustenta la diversidad de nuestras
características hereditarias. Los autosomas son los cromosomas que no están
involucrados en la determinación del sexo en los seres humanos. En otras palabras,
son los cromosomas que no son el X ni el Y.
Los autosomas se encuentran en pares, lo que significa que tenés dos copias
de cada autosoma en cada célula, uno heredado de tu madre y otro de tu padre. En
los seres humanos, se cuentan 22 pares de autosomas, junto con un par de
cromosomas sexuales que pueden ser XX o XY.
Una característica importante a destacar es la homología. Esto significa que
las dos copias de un autosoma en un individuo son homólogas, lo que implica que
tienen genes relacionados en las mismas posiciones a lo largo del cromosoma.
El estudio de los autosomas y sus genes tiene aplicaciones significativas en la
genética y la medicina, como la detección de enfermedades genéticas y la
investigación de rasgos hereditarios, en la que el estudio de los genes de los
autosomas ayuda a comprender la base genética de los rasgos hereditarios y las
enfermedades.


Autosomico dominante
Autosomico dominante
El término "autosómico dominante" se refiere a un patrón de herencia genética
en el que un solo alelo mutado en un par de cromosomas autosómicos puede causar
una enfermedad o determinar un rasgo específico. Esto significa que si una persona
hereda una copia del gen mutado de cualquiera de los padres, desarrollará la
condición o mostrará el rasgo dominante, incluso si la otra copia del gen es normal.
En un alelo dominante, la mutación es suficiente para expresar el rasgo o
enfermedad asociada. Aún si el alelo opuesto es normal, el efecto del alelo
dominante se manifiesta, lo que se conoce como dominancia sobre el alelo normal.
En el caso de un trastorno autosómico dominante, los descendientes de una
persona afectada tienen un 50% de probabilidad de heredar la mutación y, por ende,
manifestar el trastorno. Esta distinción se hace notable al compararla con los
trastornos autosómicos recesivos, donde se requieren dos copias mutadas del gen
(una de cada progenitor) para que el trastorno se manifieste.
Un ejemplo ilustrativo de un trastorno genético autosómico dominante es la
enfermedad de Huntington. En este caso, la presencia de una sola copia mutada del
gen asociado con la enfermedad, heredada de uno de los padres, es suficiente para
desarrollar la enfermedad.
Una curiosidad sobre este tema es la penetrancia variable. Aunque una
persona puede heredar un gen autosómico dominante, la gravedad de la enfermedad
o la expresión del rasgo pueden variar ampliamente entre individuos. Esto se conoce
como "penetrancia variable", y puede deberse a factores genéticos o ambientales.


C
Cariotipo
Cariotipo
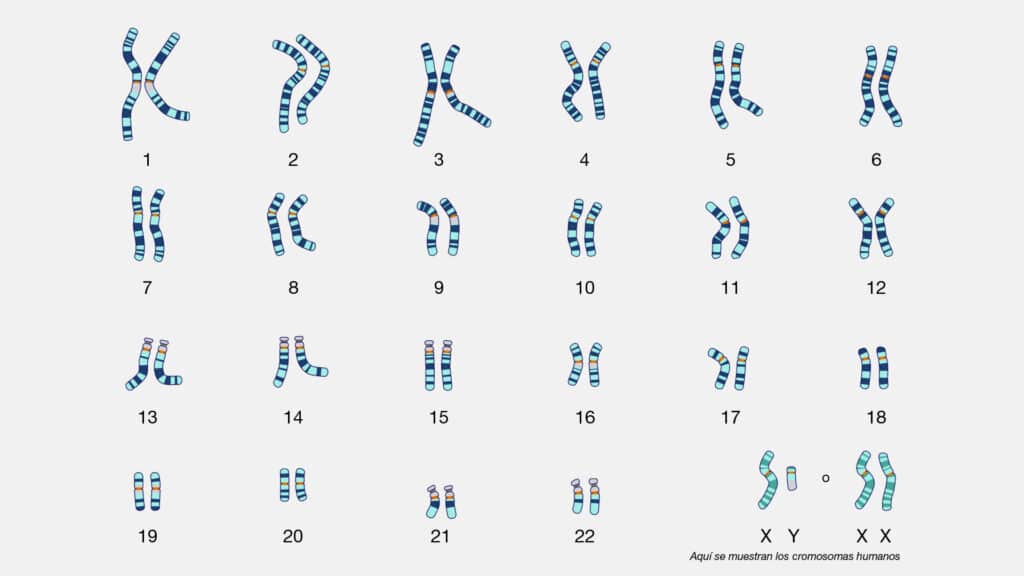
El cariotipo, esa ventana al mundo oculto de nuestros genes, es un mapa
visual de los cromosomas de un individuo. Cada célula humana contiene 46
cromosomas, organizados en 23 pares, siendo 22 de ellos autosomas y un par de
cromosomas sexuales, XX en las mujeres y XY en los hombres.
El proceso de construcción de un cariotipo comienza con la obtención de
células en división activa, como las células sanguíneas por ejemplo, las cuales son
estimuladas para que se dividan. Posteriormente, se frena la mitosis en una fase
temprana, generalmente la metafase, ya que es el punto máximo de condensación
cromosómica. La detención de la mitosis en la metafase se logra mediante el uso de
agentes químicos, como lo es la colchicina, que interfieren con la formación del huso
mitótico. Esto detiene la división celular en un punto en el que los cromosomas están
altamente condensados y bien definidos, lo que facilita su observación. Luego, estas
células se tiñen para que los cromosomas sean visibles bajo un microscopio. Por
último, los cromosomas son organizados y fotografiados, y para ello, se emparejan
cromosomas homólogos y se los ordena según su tamaño y patrón de bandas. Esto
es crucial para identificar cualquier anomalía cromosómica, como deleciones,
duplicaciones o translocaciones.
Hay una amplia gama de aplicaciones del cariotipo, pero principalmente se
utiliza en el diagnóstico de enfermedades genéticas, como el Síndrome de Down, el
Síndrome de Turner y el Síndrome de Klinefelter, producidas por alteraciones en el
número o estructura de los cromosomas. También es de gran utilidad en el campo de
la fertilidad y reproducción, donde el cariotipo se utiliza para evaluar la causa de
problemas de fertilidad, como abortos espontáneos recurrentes, la infertilidad
inexplicada o los trastornos del desarrollo sexual.

Celulas somaticas
Celulas somaticas
Las células somáticas son las obreras incansables del cuerpo humano,
componiendo la gran mayoría de nuestras células. A diferencia de las células
sexuales, las somáticas no están implicadas en la reproducción, pero son esenciales
para el crecimiento, mantenimiento y funcionamiento del cuerpo. Estas células llevan
a cabo una amplia variedad de tareas vitales, desde la construcción de tejidos hasta
la respuesta inmunológica.
Las células somáticas son diploides, lo que significa que tienen dos juegos
completos de cromosomas, uno heredado de cada progenitor. Este conjunto genético
completo permite la expresión de todas las características físicas y funcionales del
individuo. Durante el desarrollo embrionario, las células somáticas experimentan
procesos de diferenciación para convertirse en células especializadas, como células
musculares, neuronas o células sanguíneas. Esta especialización, denominada
diferenciación celular, permite la formación de tejidos y órganos con funciones
específicas.
Aunque las células somáticas tienen una vida limitada y eventualmente
mueren, algunas, como las neuronas, pueden durar toda la vida de una persona. La
replicación celular continua de las células somáticas está relacionada con el proceso
de envejecimiento. A medida que las células se dividen, los telómeros, las
estructuras protectoras en los extremos de los cromosomas, se acortan,
desencadenando un reloj molecular que finalmente dicta el destino de la célula. Esto
está directamente vinculado al proceso de envejecimiento y diversas enfermedades
relacionadas con la edad.
Dentro de sus múltiples aplicaciones, las células somáticas se utilizan en
terapias celulares para tratar enfermedades y lesiones. Por ejemplo, en la terapia de
reemplazo celular, las células somáticas pueden ser manipuladas y trasplantadas
para reemplazar células dañadas en enfermedades como la diabetes o la
enfermedad de Parkinson. Así como también tienen un rol crucial en la investigación
biomédica, donde el estudio de su comportamiento y diferenciación ayuda a
comprender mejor las enfermedades y desarrollar tratamientos más efectivos y
personalizados.


Centimorgan
Centimorgan
El centimorgan, también conocido como unidad de mapa genético, es una
medida fundamental en genética que describe las distancias relativas entre los genes
a lo largo de un cromosoma. A diferencia de las medidas físicas como la longitud en
pares de bases, el centimorgan se basa en la frecuencia de recombinación genética
durante la meiosis, el proceso de división celular que da lugar a los gametos (óvulos
y espermatozoides).
Durante la meiosis, los cromosomas homólogos intercambian segmentos de
ADN en un proceso llamado recombinación genética. Cuanto más frecuente es este
intercambio entre dos genes, más cerca están en el cromosoma. Los científicos
utilizan la frecuencia de recombinación para crear mapas genéticos. Entonces, se
estableció que un centimorgan representa una tasa del 1% de recombinación entre
dos loci (posiciones de genes) en un cromosoma durante una generación.
En el contexto humano, el mapeo genético basado en centimorgans se utiliza
para identificar genes asociados con enfermedades genéticas, permitiendo
diagnósticos precisos y desarrollando terapias específicas. Sin embargo, su uso
abarca otros campos de la biología y biotecnología, como lo es la agricultura, donde
los mapas genéticos basados en centimorgans ayudan a seleccionar características
deseables en diversos cultivos, acelerando así el proceso de mejora genética.


Centromero
Centromero
El centrómero es una estructura fundamental que asegura la correcta
segregación de los cromosomas durante la división celular, garantizando que cada
célula hija reciba la dotación genética correcta. Durante la mitosis, los centrómeros
aseguran que los cromosomas se alineen correctamente en el huso mitótico y se
separen hacia los polos opuestos de la célula. Sin embargo, su función va más allá
de ser un simple supervisor de la segregación cromosómica. Esta región única del
genoma, constituida por secuencias de ADN específicas y una variedad de proteínas,
también desempeña un papel crucial en la estabilidad genética y la evolución. Su
estructura altamente conservada a lo largo de las especies revela su importancia
ancestral y su contribución continua a la diversidad biológica.
Sus aplicaciones más relevantes se relacionan con su uso en el estudio de
enfermedades genéticas, ya que algunas mutaciones en las secuencias del
centrómero o en las proteínas asociadas a éste, pueden dar lugar a errores en la
segregación cromosómica, provocando enfermedades como el síndrome de Down.
También, su estudio es ampliamente investigado en la terapia génica, donde
comprender el orden, función y detalles precisos de los centrómeros es esencial para
garantizar que los genes insertados en terapias génicas sean transportados y
heredados correctamente por las células hijas.


Citogenetica
Citogenetica
La citogenética es una rama especializada de la genética que se enfoca en el
estudio de los cromosomas y sus alteraciones. Principalmente, se aborda el análisis
de la estructura, función y comportamiento del ADN, el cual se condensa durante la
división celular y da origen a los cromosomas. Para ello, la citogenética emplea
técnicas como el bandeo cromosómico (citogenética clásica) o la hibridación in situ
de sondas marcadas con fluorescencia en el campo de la citogenética molecular.
El análisis citogenético arranca con la obtención de células (se suelen utilizar
generalmente células del tejido sanguíneo). Luego se cultivan y preparan para el
análisis, donde se tratan para detener la división celular en la etapa de la mitosis y se
tiñen para que los cromosomas sean visibles bajo un microscopio. Los citogenetistas
examinan los cromosomas cuidadosamente, buscando alteraciones en su número,
forma o estructura. Además del análisis visual, la citogenética utiliza técnicas
moleculares como la hibridación in situ fluorescente (FISH) para estudiar regiones
específicas de los cromosomas y detectar anomalías genéticas más sutiles.
Si bien la citogenética cumple un rol fundamental en el campo de la
investigación y diagnóstico de enfermedades, se extiende más allá del estudio de
cromosomas humanos. Existen variedades cromosómicas entre especies, es decir,
los humanos tenemos 46 cromosomas organizados en 23 pares, pero los perros por
ejemplo, tienen 78 cromosomas ordenados en 39 pares. En el campo de la
taxonomía, el uso de la citogenética para determinar el número de cromosomas del
organismo de estudio, ha permitido la identificación de varias especies y la distinción
de subespecies.


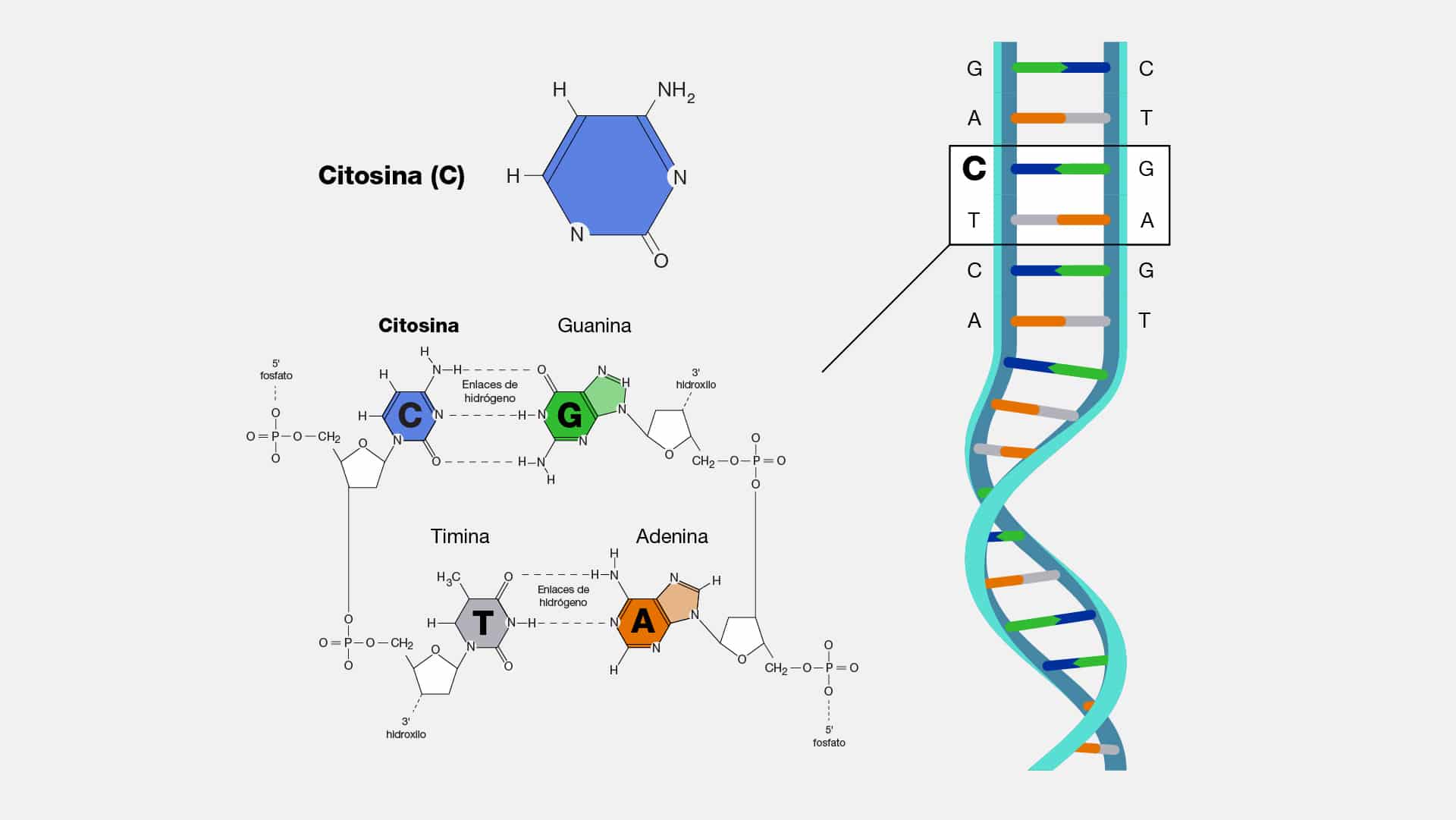
Citosina
Citosina
La citosina (C) es una de las cuatro bases nitrogenadas que forman parte del
código genético del ADN, junto con la adenina (A), guanina (G) y timina (T). Es una
pirimidina que se empareja específicamente con una guanina, mediante enlaces de
hidrógeno, formando así los pares de bases en la doble hélice del ADN.
La citosina puede ser modificada epigenéticamente, un proceso que altera la
expresión génica sin cambiar la secuencia de ADN. La metilación de la citosina, por
ejemplo, regula qué genes son activos o inactivos en una célula, desempeñando un
papel crítico en el desarrollo y la diferenciación celular. El estudio de estos procesos
son fundamentales en la investigación genética y en la comprensión de
enfermedades genéticas y cancerígenas. Por su parte, la manipulación de las
modificaciones de citosina se está investigando como una forma potencial de
tratamiento en terapias epigenéticas.

Clonacion
Clonacion
La clonación es el proceso mediante el cual se crea una copia idéntica de un
organismo, célula o molécula. Existen diversos tipos de clonación en el campo de la
biología, sin embargo, aquí nos enfocaremos en la clonación molecular y
reproductiva. La primera, implica la replicación de segmentos específicos de ADN,
como genes o fragmentos génicos para su estudio en el laboratorio. Esta técnica es
fundamental para la investigación genética y el desarrollo en diversas terapias. En
cuanto a la clonación reproductiva, consiste en crear un organismo genéticamente
idéntico a otro. En mamíferos, esto se ha logrado mediante la transferencia nuclear,
donde el núcleo de una célula somática se inserta en un óvulo enucleado y luego se
estimula para que se desarrolle en un organismo completo.
En 1996 el nacimiento de la oveja Dolly marcó un antes y un después en el
campo de la ingeniería genética, ya que fue el primer mamífero clonado a partir de
una célula adulta.


Codigo genetico
Codigo genetico
Pensemos por un momento, que cada ser vivo en nuestro vasto planeta es un
libro inmenso y complejo, pero escrito en un lenguaje universal: el código genético.
En su esencia, este alfabeto de la vida, es un conjunto de instrucciones maestras,
codificadas en moléculas de ADN, que dicta cómo se construye y opera cada ser
vivo. Está compuesto por cuatro letras, las bases nitrogenadas: adenina (A), timina
(T), citosina (C) y guanina (G), que se agrupan en tripletes llamados codones.
El código genético tiene dos características distintivas: la universalidad y la
redundancia. La primera, implica que todos los seres vivos del planeta lo utilizan,
desde las bacterias del suelo hasta las ballenas en el océano. En cuanto a la
segunda característica mencionada, podemos afirmar que el código genético es
redundante y eficiente. Esto significa que un aminoácido puede estar codificado por
más de un codón, lo que proporciona una especie de "respaldo de seguridad",
permitiendo que pequeñas mutaciones en el ADN no alteren excesivamente las
proteínas producidas.
Sus aplicaciones son extensas, sin embargo, su uso ha marcado un antes y
un después en la medicina personalizada, donde permite tratamientos basados en el
perfil genético del paciente. También es un recurso útil en el campo de la
biotecnología, donde se utiliza para modificar organismos y producir medicamentos,
alimentos genéticamente modificados y enzimas útiles en la industria.
Una de las curiosidades más sorprendentes del código genético es que
científicos han enviado representaciones gráficas de éste en naves espaciales, como
parte de mensajes a posibles formas de vida extraterrestre.


Codominancia
Codominancia
La codominancia se manifiesta cuando dos alelos se expresan plenamente en
un individuo heterocigoto. A diferencia de la dominancia completa, donde un alelo se
impone sobre el otro, en la codominancia, ambos alelos son visibles, creando un
fenotipo único que muestra características de ambos.
En la codominancia de expresión completa, los individuos heterocigotos para
un gen codominante, expresan ambos alelos por completo. Por ejemplo, si un alelo
determina el color rojo de una flor y otro el color blanco, en la codominancia, los
individuos heterocigotos tendrían flores completamente rojas y blancas, y no
encontraríamos no una mezcla rosada.
Dentro de los diversos ejemplos que podemos encontrar de codominancia, se
encuentra el sistema de grupos sanguíneos AB0, donde los alelos para los tipos de
sangre A y B son codominantes. Si heredás un alelo A de un padre y un alelo B del
otro, vas a tener sangre de tipo AB, expresando ambos alelos en tu tipo de sangre.
Una curiosidad impresionante de la codominancia es su participación en la
evolución del camuflaje. En algunos insectos y animales marinos, los patrones de
coloración codominantes han evolucionado para crear una variedad de camuflajes,
ayudándoles a adaptarse a diferentes entornos.


\
Codon
Codon
Podemos pensar en el codón como el alfabeto con el que se escriben las
palabras y las frases en el idioma genético. Son combinaciones de tres nucleótidos
que indican la producción de un aminoácido específico.
De la misma manera que el código genético, los codones se caracterizan por
su universalidad y redundancia. Existen 64 combinaciones posibles de codones, pero
sólo 20 aminoácidos, esto significa que varios codones pueden codificar para el
mismo aminoácido.
Algunos codones tienen funciones especiales. Por ejemplo, el codón AUG
sirve como señal de inicio para la síntesis de proteínas, mientras que UAA, UAG y
UGA son codones de parada, indicando el final de la cadena de aminoácidos.
Actualmente, el estudio de codones de parada se utiliza para detectar mutaciones, ya
que cuando ésto ocurre se producen proteínas anormalmente largas.
Los científicos creen que los primeros codones pudieron haber surgido hace
más de 3,5 mil millones de años, en los comienzos de la vida en la Tierra.


Congenito
Congenito
En su esencia, lo congénito se refiere a aquello que está presente desde el
inicio, inscrito en el código genético desde el principio de los tiempos. Es como si la
biología nos otorgara un manual de instrucciones desde el comienzo. En el ámbito de
la genética, los cimientos de nuestra existencia se establecen antes de que demos
nuestro primer suspiro. Los rasgos congénitos son heredados, legados de
generación en generación, como una tradición escrita en la secuencia de ADN que
nos define.
En medicina, la comprensión de los factores congénitos es crucial para
diagnosticar y abordar enfermedades genéticas. La biología forense, por otro lado,
encuentra en lo congénito una huella única e inalterable que puede revelar la
identidad de un individuo.
¿Sabías que las huellas dactilares son congénitas? Cada ser humano lleva
consigo un diseño único y distintivo desde el momento de su nacimiento. Es como si
la naturaleza nos dotara de una firma genética visible en la palma de nuestras
manos, inscribiendo nuestra identidad desde el principio.


Consejo genetico
Consejo genetico
El asesoramiento genético representa un vínculo profesional entre los médicos
y el público en general. La búsqueda de un consejero genético puede surgir de
preocupaciones sobre antecedentes familiares o del deseo de conocer las opciones
de pruebas disponibles para prevenir problemas futuros en la familia. Se concibe el
asesoramiento genético como un proceso integral. Se trata de comprender la
contribución genética a una enfermedad, explorar formas de mitigar riesgos para
aquellos afectados y, fundamentalmente, brindar un espacio para que las personas
tomen decisiones informadas que beneficien su salud.
En el campo de la genealogía, los expertos en consejo genético contribuyen a
desentrañar los misterios de la ascendencia, proporcionando un espejo genético que
refleja el viaje ancestral de cada individuo.
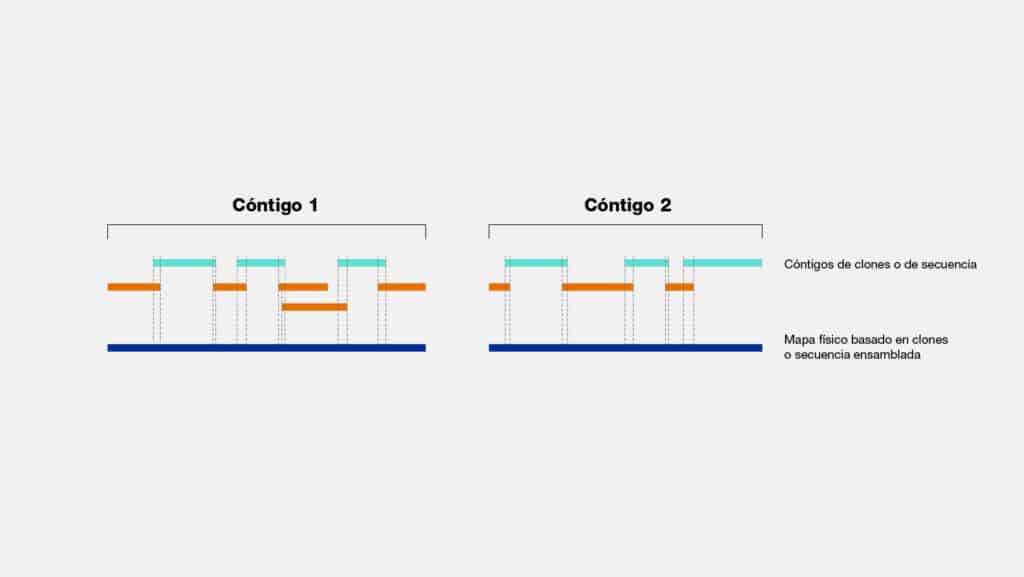
Contig
Contig
Un contig es básicamente un grupo de partes o secuencias de ADN que se
superponen parcialmente, formando en conjunto una representación continua de una
región genómica.
Imaginemos que estamos tratando de ensamblar el genoma completo de un
organismo, como una bacteria o incluso un ser humano. Estos segmentos de ADN
superpuestos, son como piezas de un rompecabezas gigante, que nos permiten
juntar y ordenar los fragmentos de ADN para obtener una imagen más clara y
completa de todo el genoma. Esto es crucial para entender la estructura genética de
un organismo y así identificar genes específicos relacionados con características
importantes, como lo son la resistencia a enfermedades o la producción de ciertas
proteínas.
En el campo de la medicina, nos permiten mapear regiones genómicas
asociadas con enfermedades hereditarias o estudiar la variabilidad genética entre
diferentes poblaciones. También son útiles en la ingeniería genética, donde pueden
ayudar a diseñar organismos modificados genéticamente para diversos fines, como
la producción de medicamentos o la biodegradación de contaminantes ambientales.

Cromatida
Cromatida
En su esencia, la cromátida es una de las dos estructuras idénticas que
componen un cromosoma. Son replicadas durante la fase S del ciclo celular,
preparándose para la división celular. Las cromátidas hermanas, unidas por un
centrómero, se mantienen firmes en su vínculo hasta el momento preciso en que se
desatan para seguir caminos distintos durante la mitosis.
En el campo de la genética y la biología celular, el estudio de las cromátidas
se convierte en una herramienta esencial para comprender los procesos de división
celular y replicación del ADN. Las anormalidades en la estructura o distribución de
las cromátidas pueden ser indicadores de enfermedades genéticas o desórdenes
cromosómicos.
¿Sabías que las cromátidas no son estáticas? Durante la división celular, se
separan y se dirigen hacia polos opuestos de la célula, guiadas por un intrincado
entramado de microtúbulos. Además, son portadoras de memoria genética, es decir,
cada cambio, cada mutación, queda registrado en la secuencia de ADN de las que
se componen. Así, las cromátidas se convierten en cronistas silenciosas de la
historia genética de una especie.


Cromatina
Cromatina
Imaginemos a la cromatina como el hilo conductor de la genética, una
compleja red de ADN y proteínas que dan forma y estructura al núcleo de nuestras
células. En este tejido genético, la cromatina se despliega en dos formas distintas: la
heterocromatina, compacta y densa, y la eucromatina, más relajada y accesible. La
cromatina, en su estado de eucromatina, permite la lectura y expresión de genes,
mientras que la heterocromatina actúa como una especie de "silenciador", donde los
genes quedan inaccesibles. Las proteínas histonas contribuyen a dar forma a la
cromatina. Estas proteínas actúan como "núcleos" alrededor de los cuales se enrolla
el ADN, formando una estructura compacta y organizada.
El estudio de la cromatina tiene un rol fundamental en la epigenética y biología
molecular, donde se exploran cómo los cambios en la estructura de la cromatina
afectan la expresión génica, desentrañando los misterios que rodean la regulación
genética. Por otro lado, en el terreno de la medicina, la cromatina también se
convierte en un punto focal en la investigación del cáncer, ya que las alteraciones en
su estructura pueden contribuir al desarrollo de células cancerosas, y comprender
estos procesos a nivel molecular es crucial para diseñar estrategias terapéuticas más
precisas.
¿Sabías que la cromatina no es estática? Durante la división celular, la
cromatina se compacta aún más para formar a los cromosomas, asegurando una
distribución ordenada de la información genética a las células hijas. Este proceso,
conocido como condensación cromosómica, es una coreografía molecular fascinante
que garantiza la integridad del material genético. Además, es sensible a las señales
ambientales, como la exposición a ciertos químicos o factores externos.
Cromosoma
Cromosoma
El cromosoma es una estructura molecular compleja y organizada compuesta
por ADN, proteínas y un toque de magia biológica. Estos paquetes ordenados de
ADN que se encuentran en el núcleo de la célula, son como capítulos en un libro de
vida, que llevan consigo la narrativa genética que define cada aspecto de nuestra
biología. Cada cromosoma alberga miles de genes, fragmentos de información que
dictan desde el color de nuestros ojos hasta la predisposición a ciertas
enfermedades.
La forma distintiva de los cromosomas, observable durante la división celular,
nos revela su habilidad para compactarse y organizarse de manera ordenada. Cada
célula humana normalmente lleva consigo 23 pares de cromosomas, un legado que
heredamos de nuestros padres. Estos pares están compuestos por uno proveniente
de la madre y otro del padre.
En el ámbito de la medicina, el estudio de los cromosomas es esencial para
comprender y diagnosticar enfermedades genéticas. Anomalías en la estructura o
número de cromosomas pueden ser indicadores de desórdenes genéticos, como el
síndrome de Down, donde hay una copia adicional del cromosoma 21.


Cromosoma sexual
Cromosoma sexual
Los cromosomas sexuales son una pareja especial de cromosomas, que
llevan consigo las instrucciones genéticas que definen nuestro sexo biológico, es
decir, si somos seres masculinos o femeninos. En las mujeres, se hereda un
cromosoma X de cada progenitor (XX), mientras que los varones, heredan el
cromosoma Y del padre que se unirá al cromosoma X de la madre (XY).
En el ámbito médico, los cromosomas sexuales se convierten en una
herramienta crucial para el diagnóstico de ciertas condiciones genéticas. Por
ejemplo, el síndrome de Turner, que se trata de una condición que afecta a las
mujeres y se caracteriza por la ausencia total o parcial de un cromosoma X. Este
ejemplo muestra cómo las variaciones en los cromosomas sexuales pueden tener
consecuencias clínicas.


Cromosoma X
Cromosoma X
Imaginemos al cromosoma X como el epicentro de la complejidad genética, un
almacén codificado de información vital que trasciende las fronteras de género. En
las células femeninas, dos cromosomas X se entrelazan en una danza genética
única, mientras que en las células masculinas, un cromosoma X se une al
cromosoma Y. Este equilibrio genético es crucial para la expresión adecuada de
genes esenciales para el desarrollo y la función celular.
El cromosoma X no solo lleva consigo instrucciones para características
sexuales, sino que también alberga un vasto repertorio de genes involucrados en
funciones vitales, desde la visión hasta la inmunidad. Existen diversas enfermedades
vinculadas a genes específicos de este cromosoma, como la hemofilia y la distrofia
muscular de Duchenne.
Las variaciones en el cromosoma X pueden proporcionar información valiosa
sobre la historia evolutiva y migratoria de las poblaciones humanas, así como
también, su susceptibilidad a ciertas enfermedades.
¿Sabías que el cromosoma X experimenta un fenómeno llamado inactivación
del cromosoma X en células femeninas? Para equilibrar la expresión génica entre
ambos sexos, uno de los cromosomas X en las células femeninas es "apagado",
formando una estructura compacta conocida como corpúsculo de Barr.


Cromosoma Y
Cromosoma Y
El cromosoma Y se presenta como el complemento del cromosoma X,
llevando la marca singular de la identidad biológica masculina. Durante la
fecundación, mientras el espermatozoide porta un cromosoma X o Y, el óvulo
siempre aporta un cromosoma X. La combinación XY delinea las características
biológicas que definen al hombre.
El cromosoma Y, aunque más pequeño en comparación al X, lleva consigo
genes cruciales para el desarrollo y función de los órganos reproductores
masculinos. Podríamos pensar que es el director en una orquesta genética que guía
desde la formación de los testículos hasta la producción de hormonas que dan forma
a las características sexuales secundarias.
En el ámbito médico, el estudio del cromosoma Y se convierte en una
herramienta invaluable para comprender y diagnosticar diversas condiciones
genéticas. Por ejemplo, podemos tomar el caso de la infertilidad masculina, que
puede estar vinculada a anomalías en este cromosoma. La investigación en esta
área no solo contribuye al diagnóstico, sino que también abre caminos para el
desarrollo de tratamientos personalizados. Además, su estudio cumple un rol
fundamental en la biología forense, ya que en los análisis de ADN para la
identificación de individuos y la variabilidad genética en regiones específicas del
cromosoma Y, se utiliza para trazar líneas de ascendencia paterna, brindando
información valiosa en investigaciones criminales y casos de paternidad.
Una curiosidad muy interesante es que el cromosoma Y ha experimentado
una especie de "encogimiento" evolutivo a lo largo del tiempo. A medida que la
evolución moldea nuestro genoma, algunas regiones del cromosoma Y han
disminuido en tamaño. Este fenómeno ha llevado a especulaciones intrigantes sobre
el destino evolutivo del cromosoma Y en el futuro.


D
Defecto congenito
Defecto congenito
El defecto congénito es una anomalía estructural o funcional presente desde
el nacimiento, tejida en los delicados hilos de la genética y la embriogénesis. Este
gran enigma de la biología puede manifestarse como una variación en la forma de un
órgano, una función comprometida o incluso una disposición genética que altera el
curso natural de la vida; como resultado de alteraciones génicas, factores
ambientales o ambos. Algunos se manifiestan como malformaciones físicas
evidentes, mientras que otros son más sutiles, afectando funciones internas
cruciales.
La investigación en genética y medicina regenerativa busca comprender y
abordar los defectos congénitos desde sus raíces moleculares. Avances en terapias
personalizadas y técnicas de edición genética ofrecen la esperanza de corregir, en el futuro, estas anomalías.


Delecion
Delecion
Una deleción, en su esencia, es un evento donde segmentos de material
genético son eliminados, alterando la armonía precisa que compone nuestro código
genético. En otras palabras, las deleciones se manifiestan como la desaparición de
fragmentos de ADN. Pueden variar en tamaño, desde la pérdida minúscula de unos
pocos pares de bases hasta la eliminación de segmentos más extensos. La
consecuencia directa se ve reflejada en la expresión de genes que a su vez, puede
afectar la síntesis de proteínas y otros procesos celulares fundamentales.
Las deleciones pueden ocurrir de forma espontánea durante la replicación del
ADN o ser heredadas de generación en generación. Su impacto depende tanto del
tamaño de la deleción como de la ubicación específica en el genoma.
En el ámbito médico, el estudio de las deleciones es esencial para entender y
diagnosticar enfermedades genéticas. Por ejemplo, el síndrome de Williams es
causado por una deleción en el cromosoma 7, afectando diversas funciones
cognitivas y físicas. Mediante terapia y edición génica, actualmente es posible
corregir deleciones patológicas o incluso insertar genes específicos en regiones
afectadas, lo que ofrece promesas innovadoras para el tratamiento de enfermedades
genéticas.
Es importante considerar que algunos genes son más tolerantes a las
deleciones que otros, en los que la pérdida de ciertos segmentos puede no tener
efectos apreciables. En cambio, en otros casos (como vimos en el ejemplo) una
deleción minúscula puede tener repercusiones significativas en la salud del individuo.
La variabilidad en la expresión de deleciones entre individuos agrega un matiz
intrigante, dado que dos personas con la misma deleción pueden experimentar
síntomas y gravedades diferentes, lo que marca una vez más, la gran complejidad de
la interacción entre factores genéticos y ambientales.


Deriva genetica
Deriva genetica
La deriva genética se refiere a los cambios aleatorios en la frecuencia de
alelos en una población a lo largo del tiempo. A diferencia de la selección natural,
que opera con una mano firme y selectiva, la deriva genética es como una brisa
evolutiva que sigue un curso incierto.
Se manifiesta con mayor fuerza en poblaciones pequeñas, donde la
variabilidad genética puede fluctuar debido a eventos aleatorios, como por ejemplo,
la muerte de individuos que llevan ciertos alelos. También puede resultar en la
pérdida de alelos en una población, fenómeno conocido como deriva genética por
fijación, o en la fijación de alelos raros. En poblaciones más grandes, su impacto es
menos notorio, pero en grupos reducidos, puede conducir a cambios significativos en
la composición genética a lo largo de las generaciones.
El análisis de la deriva genética es una herramienta crucial para comprender
la historia evolutiva de las poblaciones. Estudios que analizan la variación genética
en grupos aislados o con historias demográficas específicas pueden revelar patrones
de deriva genética, informando sobre cómo las poblaciones han evolucionado a lo
largo del tiempo. Además, tiene implicaciones en la conservación de la biodiversidad.
En poblaciones pequeñas, como las que enfrentan peligros de extinción, la deriva
genética puede llevar a una pérdida de variabilidad genética, lo que aumenta la
vulnerabilidad a enfermedades y disminuye la capacidad de adaptación.


Diploide
Diploide
Un organismo o célula diploide posee dos conjuntos completos de
cromosomas, uno heredado de cada progenitor. Esta condición contrasta con la
haploide, que solo posee un conjunto de cromosomas. El estado diploide es el
protagonista en el drama de la reproducción sexual, donde la fusión de gametos
haploides da lugar a una nueva entidad genética con potencial para una diversidad
extraordinaria.
Cada célula diploide en el cuerpo humano lleva consigo dos conjuntos
completos de 23 pares de cromosomas, uno proveniente de la madre y otro del
padre. Esta duplicidad no es una redundancia, sino que permite una robustez y
flexibilidad evolutiva inigualable. El estado diploide se torna esencial durante la
reproducción, cuando los gametos haploides (provenientes de ambos progenitores)
se fusionan en un proceso llamado fecundación. Este acto mágico restaura el
equilibrio diploide, generando un nuevo ser que hereda la diversidad genética de
ambos padres.
La presencia de dos copias de cada gen proporciona una red de seguridad
genética, permitiendo compensar posibles mutaciones en una copia con la función
normal de la otra. El análisis genético en contextos clínicos a menudo se basa en la
comprensión de la diploidía y sus implicaciones en la transmisión de características
hereditarias. Además, la ingeniería genética aprovecha la naturaleza diploide de las
células para la manipulación génica, en la introducción de genes específicos o la
corrección de mutaciones, buscando preservar la estabilidad genética y funcional.


Doble helice
Doble helice
Imaginemos a la doble hélice como una coreografía perfecta en la que las
letras del código genético se entrelazan en una estructura elegante y sin igual. La
doble hélice es la forma tridimensional del ADN, la molécula que alberga las
instrucciones para la construcción y funcionamiento de todos los seres vivos.
En el nivel microscópico, la estructura de la doble hélice del ADN se asemeja
a una escalera retorcida, donde los escalones están formados por pares de bases
nitrogenadas que se unen en una armonía única. En esta danza genética, los actores
principales son la adenina (A), timina (T), citosina (C) y guanina (G), que se
emparejan de manera específica (A con T, C con G) para formar los escalones de
esta emblemática estructura. La estabilidad de la doble hélice se da gracias a los
puentes de hidrógeno que conectan las bases complementarias. Esta elegante
arquitectura no solo asegura la integridad del ADN durante la replicación, sino que
también, permite la lectura y transcripción de la información genética en la
maquinaria celular.
¿Sabías que la doble hélice no es estática? Experimenta torsiones y cambios
en su estructura en respuesta a diversos factores ambientales y biológicos. Desde la
acción de enzimas que la desenrollan y la replican antes de la división celular, hasta
la interacción con proteínas que la compactan, según las necesidades celulares.


Duplicacion
Duplicacion
La duplicación es el evento en el cual un segmento del ADN es copiado,
creando una versión idéntica o similar de la información genética original. Este acto
de clonación molecular no solo es un truco biológico ingenioso, sino que también, es
una fuerza impulsora detrás de la evolución y la diversificación del material genético.
En el escenario molecular, la duplicación se manifiesta como una obra
maestra de copia y pegado, donde ciertos segmentos de ADN son replicados en su
totalidad o parcialidad. Esto puede ocurrir de diversas maneras, desde duplicaciones
génicas completas hasta eventos más complejos que involucran secciones
cromosómicas enteras.
En el contexto evolutivo, la duplicación de genes es un fenómeno clave que
impulsa la diversificación y adaptación de las especies. Imaginemos un gen que se
duplica y una de las copias adquiere una nueva función. Este proceso, conocido
como neo-funcionalización, puede conducir a la evolución de características
novedosas y a la especialización de funciones en una especie. Por otro lado, en el
ámbito médico, la comprensión de la duplicación es esencial para el estudio de
enfermedades genéticas.


E
Edicion genica
Edicion genica
La edición génica es una herramienta revolucionaria que nos permite modificar
el ADN de organismos vivos de manera precisa y específica. En esencia, se trata de
una técnica que posibilita editar genes de manera similar a cómo se edita un texto en
un documento digital. Esto se logra mediante el uso de enzimas personalizadas,
como las nucleasas de dedos de zinc (ZFN), las proteínas de unión a diana
mayormente específica (TALEN) y, más recientemente, la técnica estrella:
CRISPR-Cas9.
El sistema CRISPR-Cas9, inspirado en la forma en que las bacterias
combaten los virus, ha sido un antes y un después en el campo de la edición génica
debido a su precisión, facilidad de uso y bajo costo. Funciona introduciendo una guía
de ARN que dirige la enzima de restricción Cas9 hacia una ubicación específica del
ADN para cortarlo. Luego, la célula utiliza su propio sistema de reparación del ADN
para corregir el corte, lo que permite insertar, eliminar o modificar secuencias
genéticas según lo deseado.
La edición génica plantea importantes cuestiones éticas y sociales. La
posibilidad de manipular el código genético de organismos vivos propone preguntas
sobre la seguridad, la equidad y los límites de la intervención humana en la naturaleza.


Efecto fundador
Efecto fundador
El efecto fundador es un fenómeno que ocurre cuando un pequeño grupo de
individuos, los fundadores, coloniza un nuevo hábitat o establece una nueva
población. Esta migración genética no solo lleva consigo el legado genético de los
fundadores, sino que también, sienta las bases para la evolución y la diversificación
de la nueva población.
El grupo fundador representa una muestra limitada de la diversidad genética
de la población original. Eventualmente, las futuras generaciones pueden heredar
una fracción de la variabilidad genética presente en la población original, y esto tiene
consecuencias en la capacidad de adaptación y en la resistencia frente a
enfermedades.
En el ámbito de la genética de poblaciones, el efecto fundador es esencial
para comprender la evolución y la historia demográfica de las especies. Por ejemplo,
algunos grupos de animales que colonizan islas remotas experimentan el efecto
fundador, y esto puede dar lugar a la aparición de nuevas especies o subespecies
con características distintivas.
¿Sabías que el efecto fundador puede llevar a la aparición de lo que se
conoce como "cuello de botella genético"? Este fenómeno ocurre cuando la
población fundadora es extremadamente pequeña, lo que resulta en una pérdida
drástica de diversidad genética. Esto puede hacer que la población sea más
vulnerable a diversas enfermedades.


Electroforesis
Electroforesis
Imaginemos por un momento un escenario en el que las moléculas se ven
obligadas a marchar en fila india a través de un campo eléctrico. Esta es la esencia
de la electroforesis, una técnica de separación que aprovecha las diferencias de
carga y tamaño de las moléculas para clasificarlas y analizarlas con precisión.
En su forma más básica, la electroforesis aprovecha la interacción entre una
matriz gelatinosa y un campo eléctrico aplicado. Al introducir una muestra en el gel y
aplicar una corriente eléctrica, las moléculas migran a través del gel, siendo
separadas por su tamaño y carga. Este proceso permite la visualización y
cuantificación de ADN, ARN, proteínas y otras biomoléculas.
Visualicemos el proceso: una electroforesis se lleva a cabo en una caja
especial, donde una carga positiva reside en un extremo y una carga negativa en el
otro. Al analizar proteínas en un gel, por ejemplo, se observa una carrera molecular.
Las proteínas, completas, son introducidas en el gel y su tamaño es evaluado; las
más pequeñas, migran más lejos en el gel y terminan en la parte inferior del mismo.
Por el contrario, las proteínas de mayor tamaño permanecen en la parte superior,
revelando así su tamaño y estructura.
En el ámbito de la investigación básica, la electroforesis emerge como una
herramienta esencial para comprender la función de genes y proteínas. Ahora, ha
irrumpido con fuerza en el diagnóstico clínico y forense, desempeñando un papel
cada vez más relevante en el análisis y caracterización de muestras biológicas.


Encruzamiento cromosomico
Encruzamiento cromosomico
En su esencia, el entrecruzamiento cromosómico es un proceso vital que
ocurre durante la meiosis, la división celular que da lugar a la formación de gametos.
En el escenario molecular, este evento se manifiesta como un intercambio físico de
material genético entre cromátidas homólogas, que ocurre en puntos específicos
llamados quiasmas, donde los cromosomas se unen temporalmente. Durante este
abrazo genético, los fragmentos de cromátidas homólogas se intercambian,
generando variabilidad genética entre las células hijas. La combinación única de
alelos en los cromosomas homólogos contribuye a la diversidad genética en las
poblaciones y es clave para la evolución.
En la genética médica, su comprensión es fundamental para analizar las
posibles causas de anomalías cromosómicas. Desbalances en el entrecruzamiento
pueden dar lugar a condiciones como la trisomía 21 (síndrome de Down), donde hay
una copia adicional del cromosoma 21, debido a errores en la meiosis.
¿Sabías que el entrecruzamiento cromosómico no ocurre de manera uniforme
a lo largo de la longitud de los cromosomas? Algunas regiones, llamadas "puntos
calientes de entrecruzamiento", son más propensas a experimentar este fenómeno y
contribuyen de manera desigual a la variabilidad genética. Además, aunque suele ser
poco frecuente, el entrecruzamiento también puede ocurrir entre cromosomas no
homólogos, en un fenómeno llamado entrecruzamiento no alélico.


Enzima de restriccion
Enzima de restriccion
Pensemos en las enzimas de restricción como tijeras precisas capaces de
cortar el ADN en lugares específicos. En su esencia, estas enzimas son
herramientas imprescindibles utilizadas por las bacterias como sistema de defensa
contra invasores virales. Su descubrimiento revolucionó la manipulación genética y
se convirtió en una piedra angular de la biotecnología moderna.
En el escenario molecular, la enzima de restricción se presenta como una
especialista en cortes quirúrgicos en la doble hélice del ADN. Su acción se centra en
secuencias específicas de nucleótidos, conocidas como sitios de restricción. Estas
tijeras moleculares pueden cortar el ADN en lugares precisos, generando extremos
cohesivos o romos según la enzima.
La maravilla de estas enzimas radica en su especificidad. Cada enzima
reconoce una secuencia de nucleótidos única y actúa como un vigilante genético,
cortando sólo en los puntos designados.
En el ámbito de la investigación y la biotecnología, las enzimas de restricción
son las herramientas fundamentales en técnicas como la clonación de genes y la
construcción de vectores de expresión. Imaginemos que queremos estudiar un gen
específico; las enzimas de restricción nos permiten cortar ese gen de manera
precisa, para luego insertarlo en un vector y estudiar su función.
Epigenetica
Epigenetica
La epigenética es una disciplina que estudia las modificaciones químicas en el
ADN y en las proteínas asociadas, cambios que no alteran la secuencia de ADN pero
sí regulan cómo se leen y se interpretan los genes. En otras palabras, las etiquetas
químicas (como la metilación del ADN y las modificaciones de histonas) actúan como
directrices que indican a la maquinaria molecular cuándo activar o silenciar ciertos
genes.
Una característica clave de la epigenética es su capacidad para ser
influenciada por el entorno y las experiencias de la vida. Factores como la nutrición,
el estrés y el ambiente pueden dejar marcas epigenéticas, creando una conexión
íntima entre nuestra historia personal y la expresión génica.
En el ámbito de la medicina, la epigenética ha revelado cómo ciertas
modificaciones pueden estar asociadas con enfermedades. Por ejemplo, la
hipermetilación de ciertos genes supresores de tumores puede estar vinculada al
desarrollo de cáncer, mientras que la hipometilación de genes puede estar
relacionada con trastornos neuropsiquiátricos. Ésta disciplina también desempeña un
papel crucial en el campo de la medicina de precisión, donde se estudian patrones
epigenéticos para prever la respuesta individual a tratamientos específicos. Esto abre
la puerta a terapias más personalizadas y efectivas, teniendo en cuenta las
características únicas de cada paciente.


Epistasis
Epistasis
La epistasis es una interacción entre genes en la que la presencia o ausencia
de un alelo en un gen, afecta el fenotipo asociado con otro gen. En el escenario
molecular, se manifiesta como una intrincada red de interacciones intergénicas,
donde la expresión de uno puede anular o potenciar los efectos de otro. A diferencia
de las interacciones genéticas más simples, la epistasis introduce una capa de
complejidad, desafiando la noción de que cada gen actúa de manera independiente.
Puede manifestarse en diferentes formas, como la epistasis aditiva, donde la
presencia de un alelo enmascara los efectos de otro, o la epistasis recesiva, donde
un alelo solo muestra su efecto en ausencia de otro alelo específico. En lugar de
seguir las reglas mendelianas clásicas, la epistasis introduce variaciones
impredecibles en la herencia genética.
La epistasis tiene implicaciones importantes en la genética de enfermedades y
en la identificación de factores de riesgo. Por ejemplo, en enfermedades complejas
como la diabetes tipo 2, puede modificar la influencia de ciertos genes en el riesgo de
desarrollar la enfermedad. Comprender estas interacciones genéticas puede ser
crucial para el diseño de estrategias terapéuticas y preventivas más precisas.


Estudio de asociación de genoma completo (GWAS)
Estudio de asociación de genoma completo (GWAS)
Imaginemos el Estudio de Asociación de Genoma Completo como un
detective biológico que rastrea pistas en todo el genoma humano para descubrir qué
variantes génicas están vinculadas a ciertas condiciones o rasgos. Básicamente,
este estudio examina todo el genoma en busca de asociaciones estadísticas entre
ciertas variaciones genéticas y características fenotípicas, proporcionando un mapa
detallado de la influencia genética en una amplia variedad de fenotipos.
En el escenario científico, el Estudio de Asociación de Genoma Completo
(GWAS, por sus siglas en inglés) se despliega como un análisis masivo de datos
genómicos, explorando millones de variantes genéticas en miles o incluso millones
de individuos. La característica estelar de este estudio, es su enfoque en variantes
de un solo nucleótido (SNPs), marcadores genéticos comunes que pueden estar
asociados con ciertas características. La frecuencia de estos SNPs se compara entre
individuos con y sin el rasgo de interés, revelando patrones de asociación que guían
a los científicos hacia las regiones del genoma que pueden estar vinculadas a la
variación fenotípica.
En el ámbito de la farmacogenómica, este estudio ha contribuido a
comprender cómo las variaciones genéticas pueden influir en la respuesta individual
a medicamentos. Identificar variantes genéticas que afectan la eficacia y seguridad
de los tratamientos permite una medicina más personalizada y precisa


Evaluación del recién nacido o examen neonatal
Evaluación del recién nacido o examen neonatal
Imaginemos el examen neonatal como un destello de luz en los primeros días
de vida, iluminando los rincones más íntimos del código genético de un recién
nacido. Este examen es una evaluación exhaustiva de la salud del bebé, dirigida a
detectar de manera temprana condiciones genéticas, metabólicas o endocrinas que
podrían afectar su desarrollo. Se realiza, generalmente, a través de una pequeña
muestra de sangre tomada del talón del neonato.
La característica estelar de este examen es su capacidad para identificar
condiciones tratables o manejables de manera temprana, antes de que los síntomas
se manifiesten. Es esencial en la detección de condiciones como la fibrosis quística,
la fenilcetonuria, el hipotiroidismo congénito o ciertos trastornos de hemoglobina

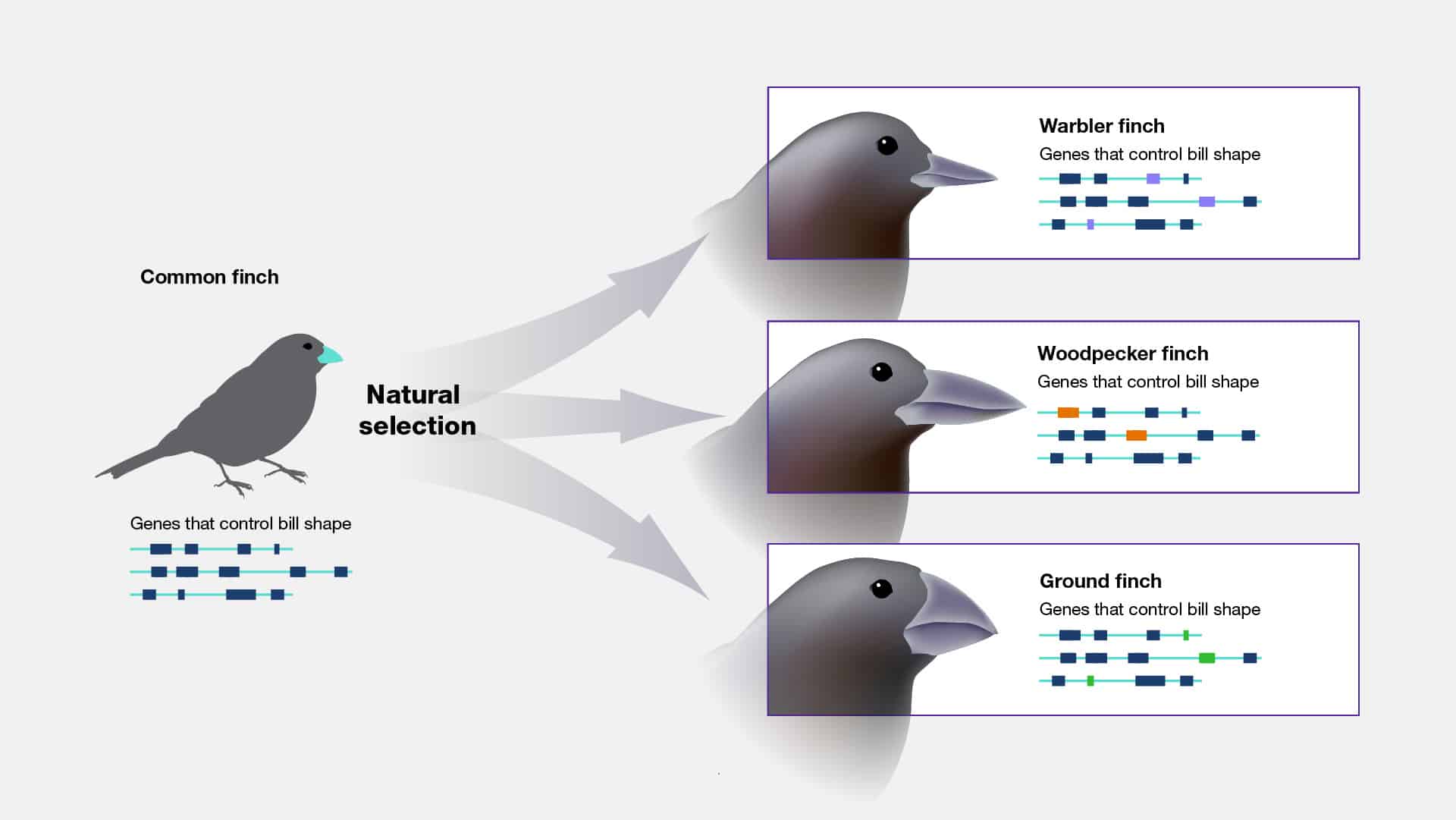
Evolucion
Evolucion
La evolución, en su esencia, es el proceso continuo mediante el cual las
especies cambian y se adaptan a lo largo del tiempo, impulsadas por la presión
selectiva y la variación genética inherente. Desde el vuelo majestuoso del águila
hasta el inquietante camuflaje del camaleón, cada rasgo y comportamiento encuentra
su origen en esta danza perpetua entre un organismo y su entorno.
Las características distintivas de la evolución son tan diversas como las
formas de vida que se encuentran. La selección natural, concebida por el gran
Charles Darwin, actúa como el escultor invisible, tallando y moldeando poblaciones a
lo largo de las generaciones en respuesta a los desafíos ambientales. La deriva
genética introduce cambios aleatorios que pueden afianzarse o desaparecer en el
telón de fondo de la historia evolutiva. Por otro lado, la especiación (un acto de
división y divergencia) engendra la rica diversidad de formas de vida que adornan
nuestro planeta.
Tenemos que tener en cuenta que la evolución no es solo un cuento del
pasado distante, sino que es una fuerza activa y palpable en el mundo moderno. En
la agricultura, la selección artificial ha dado forma a cultivos que alimentan a la
humanidad, desde el maíz domesticado hasta el arroz cultivado. En la medicina, la
resistencia antimicrobiana es un recordatorio urgente de la capacidad de los
organismos para adaptarse y evolucionar en respuesta a las presiones terapéuticas.

Exon
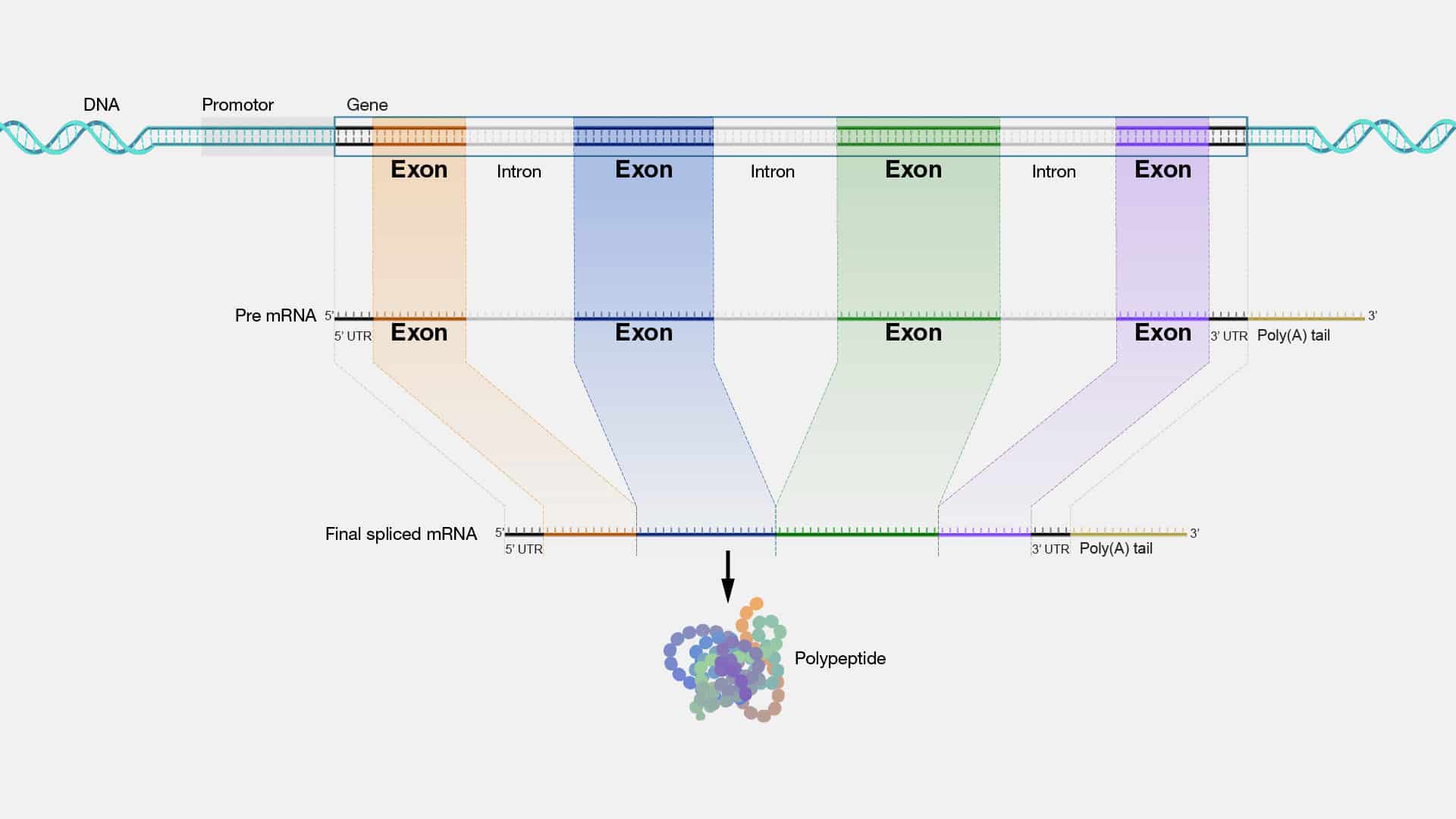
Exon
Los exones son los bloques de construcción que dan forma a nuestra biología
y definen nuestra singularidad génica. En el escenario molecular, se manifiestan
como secuencias de ADN que codifican información genética. Su posición dentro de
un gen determina cómo se ensamblarán con otros fragmentos de ADN (llamados
intrones) para formar el mensaje genético completo. La edición precisa de estos
exones es crucial para la función adecuada de las proteínas, y por ende, para la vida
misma.
Una característica destacada de los exones es su papel en el proceso de
splicing o también conocido como “corte y empalme”; una especie de "montaje
genético" donde los exones se unen entre sí y se eliminan los intrones para formar el
ARN mensajero (ARNm) maduro.
En la investigación médica, el estudio y comprensión de la estructura y el rol
de los exones es clave para descifrar las bases genéticas de enfermedades. Por
ejemplo, mutaciones en exones pueden dar lugar a condiciones genéticas
hereditarias como la distrofia muscular o la hemofilia. Analizar los exones en
pacientes puede proporcionar pistas cruciales para el diagnóstico y el desarrollo de
terapias personalizadas.

Expresion genica
Expresion genica
La expresión génica es el arte de traducir las instrucciones genéticas en
acciones concretas dentro de la célula. Es decir, es el proceso mediante el cual la
información codificada en el ADN se convierte en productos funcionales, como
proteínas y ARN.
¿Qué características definen este fascinante proceso? Bien, primero, su
dinamismo. La expresión génica puede ser alterada por una variedad de factores
internos y externos, desde señales químicas dentro de la célula hasta condiciones
ambientales que rodean al organismo. Esta plasticidad permite una adaptación
rápida y eficiente a cambios en el entorno, garantizando la supervivencia y el
bienestar. Además, exhibe una precisión exquisita. Cada gen es regulado con
precisión milimétrica, asegurando que se active o desactive en el momento adecuado
y en la cantidad exacta requerida. Este nivel de control es crucial para mantener el
equilibrio en el organismo y prevenir desarreglos que puedan llevar a enfermedades
o trastornos genéticos.
Un dato no menor, es que las células de nuestro cuerpo expresan solo una
fracción de sus genes en un momento dado. Este fenómeno, conocido como
expresión génica diferencial, permite que diferentes células desempeñen funciones
especializadas, a pesar de contener el mismo conjunto de instrucciones genéticas.
En la medicina, entender este proceso es vital para desentrañar las causas de
diversas enfermedades. Por ejemplo, la investigación sobre la expresión génica en
células cancerosas ha revelado patrones distintivos que pueden ayudar en el
diagnóstico y tratamiento personalizado de distintos tipos de cáncer.
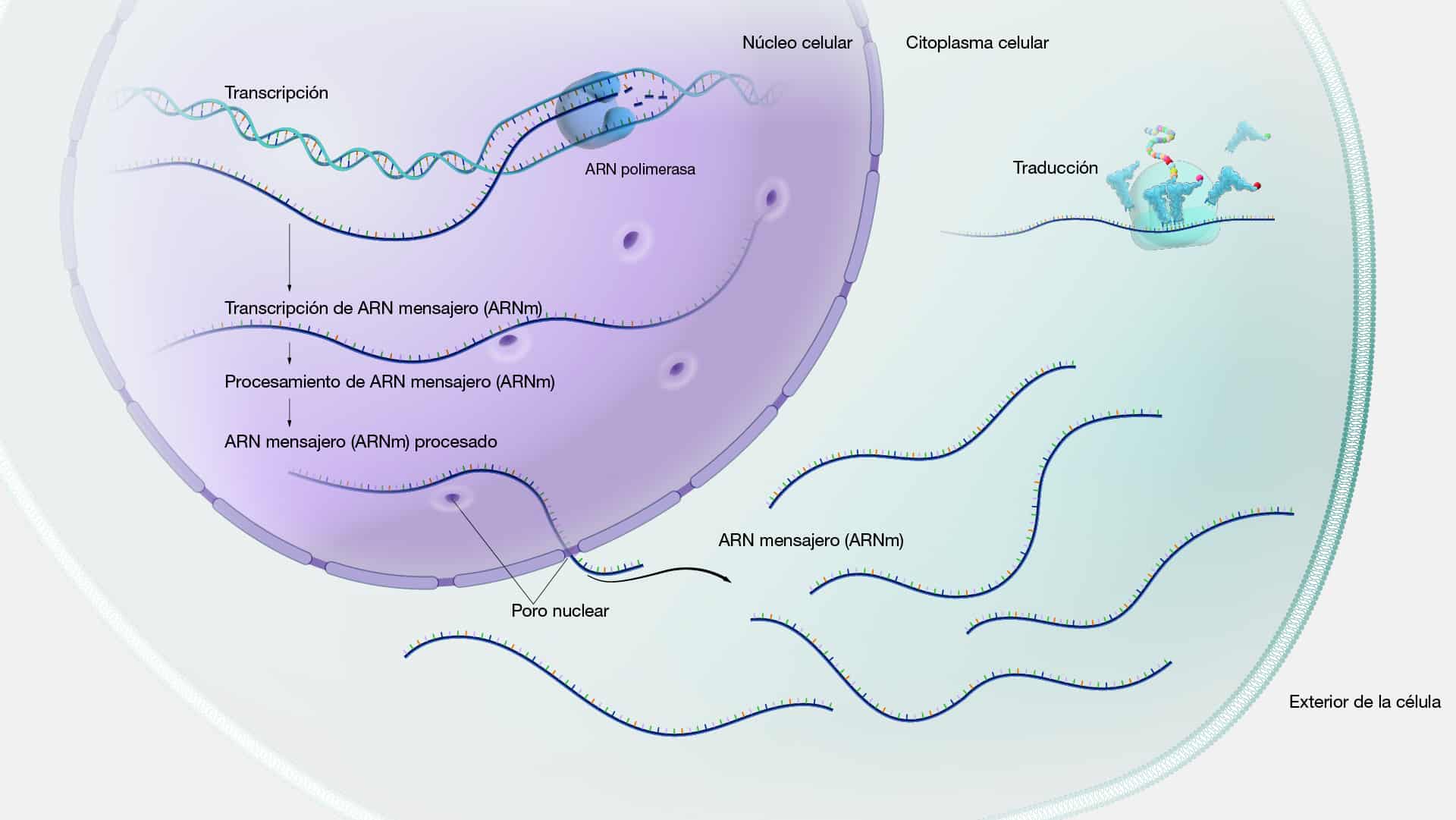

F
Fenotipo
Fenotipo
Imaginemos al fenotipo como la interpretación de la partitura genética, la
expresión visible de los genes en la realidad física de un organismo. En su esencia,
es la combinación de características observables, desde la apariencia y el
comportamiento, hasta la susceptibilidad a enfermedades, que define la identidad
biológica de un individuo. El fenotipo se manifiesta como el resultado de la
interacción entre el genotipo (la información genética heredada) y el entorno.
Una característica destacada de éste es su plasticidad, es decir, su capacidad
para adaptarse a cambios en el medio. Este fenómeno permite a los organismos
ajustar su expresión fenotípica en respuesta a estímulos externos, desde la dieta
hasta el clima, demostrando así la versatilidad de la vida.
En la investigación médica, el estudio del fenotipo es clave para comprender
la predisposición a enfermedades. Por otro lado, cumple un rol crucial en la
agricultura; donde la selección de cultivos con fenotipos deseables, como mayor
resistencia a enfermedades o mejor rendimiento, ha sido un componente vital en la

Fijador
Fijador
El fijador es una solución química diseñada para detener los procesos
biológicos en las células y tejidos, evitando la degradación y manteniendo su
morfología y composición intactas. Es fundamental para la observación microscópica,
ya que este tipo de muestras son inherentemente dinámicas y pueden sufrir
alteraciones rápidas y significativas después de la extracción.
El fijador actúa de varias maneras. En primer lugar, desnaturaliza las
proteínas, impidiendo que las enzimas y otros agentes biológicos alteren la
estructura celular. A su vez, interrumpe los procesos de autolisis y putrefacción al
estabilizar las membranas celulares y mantener la integridad de las organelas. Esto
garantiza que las muestras conserven su apariencia y características bioquímicas
durante el proceso de preparación y análisis microscópico.
En el campo de la citogenética existen diferentes tipos de fijadores, cada uno
con sus propias características y aplicaciones específicas. Por ejemplo, el fijador de
Carnoy, compuesto principalmente por alcohol y ácido acético, es ideal para
preservar los cromosomas en tejidos sólidos, como biopsias de tejido tumoral.
Fragmentos de restricción de longitud polimórfica (RFLP)
Fragmentos de restricción de longitud polimórfica (RFLP)
Pensemos en los Fragmentos de Restricción de Longitud Polimórfica (RFLP),
como marcadores genéticos que brillan como estrellas en el increíble firmamento del
ADN, señalando regiones específicas de variabilidad genética. Básicamente, son
fragmentos de ADN que varían en longitud entre individuos debido a diferencias en la
secuencia de nucleótidos reconocida por enzimas de restricción.
Los RFLP se manifiestan como huellas dactilares genéticas, evidenciando las
variaciones en el ADN que distinguen a cada individuo. Estas variaciones surgen de
la presencia o ausencia de sitios de restricción específicos para las enzimas, creando
patrones únicos que pueden ser analizados mediante técnicas como la electroforesis
en gel.
En la medicina forense, han sido protagonistas en la identificación de
individuos. Los patrones únicos de RFLP permiten la comparación de muestras de
ADN, contribuyendo a resolver crímenes, identificar restos humanos y establecer
relaciones familiares. Su utilidad en la investigación de enfermedades genéticas, se
ha convertido en una herramienta fundamental. Por ejemplo, en el estudio de
trastornos como la fibrosis quística o la hemofilia, la identificación de marcadores
RFLP específicos ha facilitado la detección de mutaciones genéticas asociadas.
Desde sus orígenes, ha revolucionado completamente el campo de estudio de
la biología celular. Los RFLP fueron pioneros en la era de la genética molecular. Su
aplicación en la década de 1980 marcó un hito en la capacidad de analizar y
comprender el ADN a nivel molecular, allanando el camino para tecnologías más
avanzadas en la era genómica actual.

G
Gemelos identicos
Gemelos identicos
Los gemelos idénticos son dos individuos que comparten el mismo material
genético. En su esencia, son el resultado de la división de un solo óvulo fertilizado en
dos embriones separados, una rareza que despierta asombro en el mundo de la
genética.
En el escenario biológico, se manifiestan como duplicados genéticos
perfectos, con secuencias de ADN prácticamente idénticas. Aunque comparten el
mismo patrimonio genético, ciertas variaciones epigenéticas y del medio pueden
influir en sus características físicas y rasgos distintivos. Esta capacidad para revelar
la contribución relativa de factores genéticos y ambientales en el desarrollo de rasgos
específicos, es una singularidad muy valorada en el ámbito de la investigación y la
medicina. Estudios comparativos entre gemelos idénticos y no idénticos han sido
esenciales para desentrañar la danza compleja entre la herencia y el entorno.
En medicina, al estudiar gemelos donde uno padece una enfermedad y el otro
no, los científicos pueden identificar factores genéticos y ambientales que
contribuyen a la susceptibilidad de enfermedades como el cáncer, la diabetes o
trastornos neuropsiquiátricos. Por otro lado, su similitud genética proporciona un
contexto ideal para estudiar cómo la variabilidad genética se traduce en diferencias
en la respuesta a tratamientos médicos, apuntando hacia una medicina más precisa
y personalizada.
¿Sabías que aunque los gemelos idénticos tienen un mismo origen genético,
no siempre comparten la misma identidad de huellas dactilares? Esto se debe a las
influencias mecánicas y ambientales durante el desarrollo fetal que dan lugar a
ligeras diferencias en las crestas dérmicas.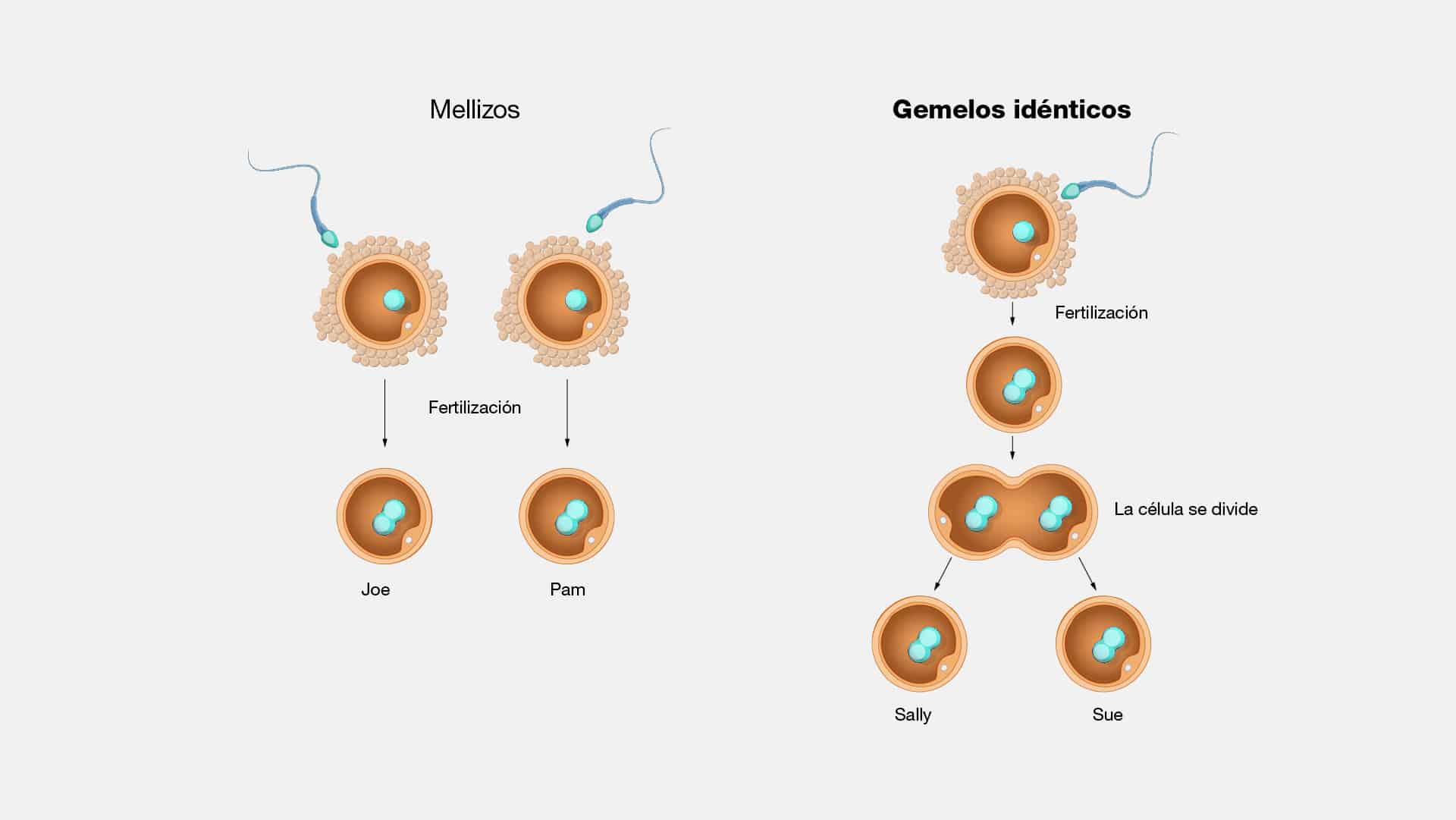

Gen
Gen
Un gen es una secuencia de nucleótidos específica que codifica instrucciones
para la síntesis de proteínas, las obreras moleculares que construyen y mantienen
nuestro cuerpo. Es decir, cada gen lleva la receta para la creación de una proteína
única.
Una característica estelar de los genes es su capacidad para mutar y
evolucionar. A lo largo de millones de años, los genes han experimentado cambios
que han dado lugar a la diversidad de formas de vida que poblamos la Tierra. La
variabilidad genética es la esencia misma de la evolución.
Los ejemplos de aplicación de su estudio son extensos. La identificación de
mutaciones en genes específicos ha posibilitado el desarrollo de pruebas genéticas
que ayudan en el diagnóstico y asesoramiento genético, permitiendo a las personas
tomar decisiones informadas sobre su salud y la de sus descendientes. En la
agricultura, la ingeniería genética ha llevado a la creación de cultivos transgénicos;
donde la introducción de genes específicos en plantas, ha mejorado su resistencia a
plagas, su tolerancia a condiciones adversas y su rendimiento, contribuyendo a la
seguridad alimentaria mundial.
¿Sabías que el genoma humano contiene alrededor de 20.000 a 25.000
genes? Aunque pareciera una cantidad relativamente pequeña, es sorprendente
cómo la combinación y expresión de estos genes da origen a la diversidad y
complejidad de cada ser humano. Además, los genes no actúan solos; interactúan en
redes complejas. Las vías metabólicas, las cascadas de señalización y la regulación
génica forman intrincadas coreografías moleculares donde múltiples genes trabajan
en conjunto para orquestar todos los procesos biológicos.
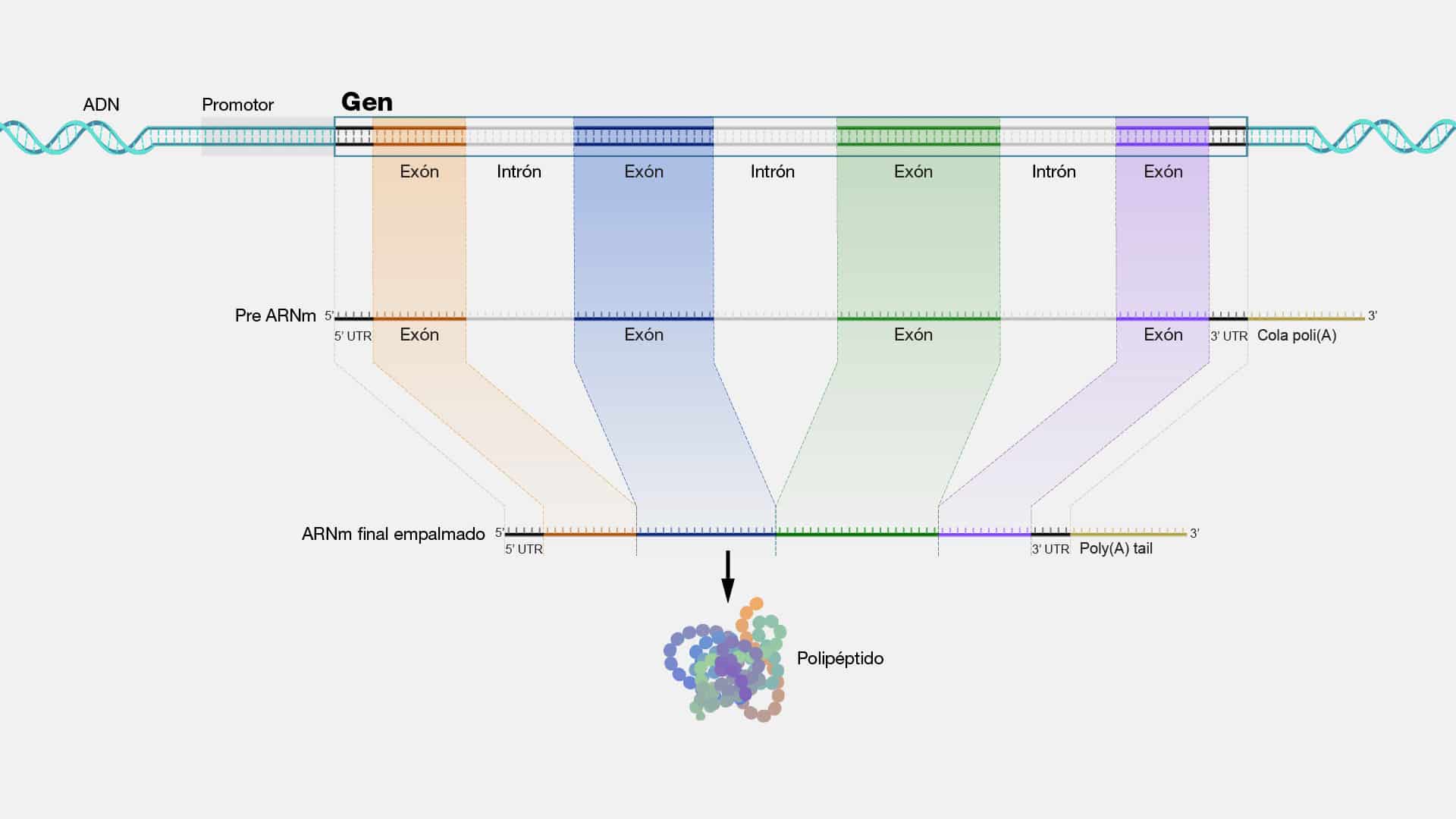

Gen candidato
Gen candidato
En el escenario genético, un gen candidato se manifiesta como una estrella
fugaz que brilla con la promesa de revelar secretos biológicos. Lo podemos definir
como aquel que presenta una ubicación exacta en el cromosoma que se correlaciona
con una enfermedad o rasgo particular bajo investigación. Pueden ser identificados
mediante estudios genómicos, asociaciones con fenotipos específicos o su
participación conocida en vías biológicas relacionadas con el rasgo de interés.
Una característica estelar de los genes candidatos es su versatilidad. Pueden
estar vinculados a una amplia variedad de fenotipos, desde rasgos físicos y
susceptibilidad a enfermedades, hasta respuestas a tratamientos médicos. Su
naturaleza sugiere que pueden ser cruciales en la comprensión de la variabilidad
biológica.
En la investigación médica, los genes candidatos han sido clave para entender
las bases genéticas de enfermedades complejas. Por ejemplo, en el estudio de
trastornos neuropsiquiátricos como la esquizofrenia o el trastorno bipolar, la
identificación de genes candidatos proporciona puntos de partida para investigar su
etiología y mecanismos subyacentes.

Genoma
Genoma
El genoma es como un manuscrito completo de nuestras instrucciones
biológicas, la totalidad de nuestro ADN que alberga la información heredada de
generación en generación. En su esencia, es el resumen genético que da forma a
nuestra biología, desde la estructura de nuestras células hasta las intrincadas
características que nos definen como individuos.
En el escenario genético, el genoma se manifiesta como una inmensa
biblioteca de genes, cada uno con una historia molecular que codifica una función
específica en el organismo, dando las instrucciones que guían el desarrollo,
funcionamiento y comportamiento de un ser vivo.
Las aplicaciones del conocimiento del genoma son múltiples y diversas.
Desde la medicina genómica, que utiliza la información genética para diagnosticar
enfermedades, predecir riesgos y diseñar tratamientos personalizados, hasta la
agricultura, donde se aplican técnicas de modificación genética para mejorar la
resistencia de cultivos a enfermedades o condiciones ambientales adversas.
Además, el estudio comparativo de genomas entre diferentes especies ha permitido
comprender mejor la evolución y las relaciones filogenéticas entre organismos. Esto
ha dado lugar a avances en la biología evolutiva, ecología y la conservación de
especies.

Genomica
Genomica
La genómica es una rama de la biología molecular que se encarga de estudiar
y analizar la información genética contenida en el ADN de los organismos. Se basa
en el estudio del genoma completo, explorando su estructura, función, evolución y
regulación, buscando descifrar el lenguaje genético en su totalidad. No se limita a
estudiar genes individuales, sino que busca comprender cómo estos interactúan y
cómo sus variaciones contribuyen a la variabilidad genética y las características
fenotípicas.
El funcionamiento de la genómica implica una serie de técnicas y
herramientas avanzadas para secuenciar, analizar y comparar los genomas. Una de
las técnicas más importantes es la secuenciación de nueva generación (NGS por sus
siglas en inglés), que permite leer miles o millones de fragmentos de ADN
simultáneamente, acelerando el proceso de secuenciación de manera eficiente.
En la medicina, la genómica ha revolucionado el diagnóstico y tratamiento de
enfermedades. La secuenciación del genoma humano ha permitido la identificación
de variantes genéticas asociadas con enfermedades hereditarias y ha allanado el
camino hacia la medicina personalizada, donde los tratamientos se adaptan a la
información genética única de cada paciente. Además, se destaca su rol como
herramienta fundamental en los estudios de mejoramiento genético animal y vegetal,
así como también, en los avances más recientes en el campo de la biotecnología.
¿Sabías que la genómica también ha revelado sorprendentes similitudes
genéticas entre especies aparentemente diversas? Al comparar genomas, se han
descubierto genes comunes entre humanos y otros organismos, destacando la
conexión evolutiva que compartimos. Además, ha llevado a los científicos a explorar
el "ADN basura", regiones del genoma que antes se consideraban sin función
aparente. Ahora, se reconoce que estas regiones desempeñan papeles cruciales en
la regulación génica y otros procesos biológicos.

Genotipo
Genotipo
El genotipo es un concepto central en la biología y la genética, que se refiere
al conjunto completo de genes de un organismo contenidos en su ADN. Es la
información genética heredada de los progenitores, que determina las características
específicas de un individuo, desde su apariencia física hasta sus predisposiciones a
ciertas enfermedades. En términos técnicos, el genotipo se compone de alelos,
variantes específicas de un gen que pueden influir en el fenotipo, es decir, en las
características observables de un organismo. Estos alelos pueden ser dominantes o
recesivos, y su interacción determina cómo se expresan los rasgos heredados.
Es importante destacar que el genotipo no es estático, ya que puede ser
modificado por factores ambientales, mutaciones genéticas y otros procesos. Estos
cambios pueden tener un impacto significativo en la salud y el comportamiento de
cada ser vivo.
En cuanto a aplicaciones prácticas, el conocimiento del genotipo es
fundamental en campos como la medicina, la agricultura y la conservación de
especies. Por ejemplo, en medicina, se utilizan pruebas genéticas para diagnosticar
enfermedades hereditarias, prever riesgos de salud y diseñar tratamientos
personalizados. En agricultura, se emplea la ingeniería genética para mejorar cultivos
y ganados, aumentando su resistencia a enfermedades y mejorando su rendimiento.
En cuanto a su aplicación en la conservación, el análisis del genotipo permite
estudiar la diversidad genética de las poblaciones y diseñar estrategias para proteger
especies en peligro de extinción.

Giemsa
Giemsa
El Giemsa es un colorante vital utilizado en microbiología y biología celular
para teñir preparaciones biológicas, en particular muestras de sangre y frotis de
tejidos. Su funcionamiento radica en su capacidad para unirse selectivamente a
ciertos componentes celulares, lo que permite visualizar estructuras específicas bajo
el microscopio. En el campo de la citogenética es muy utilizado ya que revela la
morfología básica de los cromosomas.
Los colorantes azur, que poseen una naturaleza básica, encuentran su hogar
en los ácidos nucleicos como el ADN y el ARN, tejiendo una manta de colores azules
oscuros o púrpuras sobre los núcleos y nucleolos de las células. En contraste, la
eosina, un colorante ácido, se une a las proteínas que adornan el citoplasma,
bañando este entorno celular en tonos rosados o anaranjados. La magia de la tinción
de Giemsa se despliega al permitir la distinción entre los majestuosos paisajes
nucleares y los vibrantes paisajes citoplasmáticos.
Un dato interesante sobre la tinción Giemsa es su capacidad para resaltar las
regiones ricas en adenina-timina (AT) en el ADN, dando lugar a un patrón de bandas
característico. Esta distinción de bandas permite una identificación precisa de
cromosomas específicos y facilita el análisis de su estructura y contenido genético.

Guanina
Guanina
Pensemos en la guanina (G) como la pieza clave en un rompecabezas de la
molécula de ADN; una base nitrogenada que, junto con sus compañeras adenina (A),
citosina (C) y timina (T), constituyen la secuencia genética, dando forma a las
instrucciones que guían el desarrollo y funcionamiento de los seres vivos.
En el escenario molecular, la guanina se manifiesta como una base
nitrogenada de doble anillo, una estructura elegante que se empareja
específicamente con la citosina para formar los escalones de la escalera retorcida del
ADN. Esta complementariedad asegura la estabilidad de la doble hélice y es crucial
para la replicación y transcripción del material genético.
En cuanto a las aplicaciones prácticas, la guanina y sus derivados encuentran
numerosos usos en la industria farmacéutica y cosmética. Por ejemplo, algunos
fármacos antivirales contienen estructuras basadas en guanina que interfieren con la
replicación viral. Además, en la cosmética, la guanina se utiliza en productos de
cuidado capilar, donde se le atribuyen propiedades fortalecedoras y reparadoras para
el cabello.
Además de su función en la biología molecular, la guanina es objeto de
estudio en diversas disciplinas. En la astrobiología, esta base se ha detectado en
meteoritos y se especula sobre su posible contribución en la formación de moléculas
prebióticas en el universo primordial. Este hallazgo sugiere la posibilidad de la
presencia de compuestos orgánicos esenciales para la vida más allá de nuestro
planeta.

H
Haploide
Haploide
Un haploide contiene la mitad de la historia genética celular, es la contribución
singular de uno de los progenitores que da forma a la variabilidad genética de las
generaciones venideras. En el escenario genético, el haploide se manifiesta como
células con un juego completo de cromosomas. Éstas células, como los gametos en
humanos (espermatozoides y óvulos), son la respuesta biológica al proceso de
reproducción. Cuando dos células haploides se fusionan durante la fecundación,
forman una célula diploide que hereda una combinación única de material genético
de ambos progenitores. Este proceso es esencial para la adaptación y evolución de
las especies.
En la reproducción asistida, la comprensión del estado haploide es
fundamental. Las técnicas de fecundación in vitro, por ejemplo, implican la
manipulación de gametos haploides para facilitar la concepción. Comprender la
dinámica haploide-diploide es esencial para el éxito de estas intervenciones médicas.
En la agricultura, la manipulación de células haploides es utilizada en la creación de
plantas híbridas. Al inducir la formación de éstas células y luego regenerar plantas a
partir de ellas, los agricultores pueden desarrollar distintas variedades con las
características deseadas.

Haplotipo
Haplotipo
Un haplotipo es en su esencia, el conjunto de marcadores genéticos que se
heredan juntos y que revelan una porción única de la historia genética de una familia
o población. En el escenario biológico, el haplotipo se manifiesta como un conjunto
específico de alelos en varios genes ubicados en el mismo cromosoma. Cada
haplotipo es único para un individuo, a menos que haya heredado exactamente el
mismo haplotipo de ambos padres, lo que es poco común debido a la recombinación
genética.
Al estudiar los haplotipos en poblaciones humanas, los científicos pueden
rastrear migraciones, patrones de apareamiento y adaptaciones evolutivas a lo largo
del tiempo. Es como descifrar un antiguo mapa genético que nos lleva a través de los
siglos.
En la investigación médica, los haplotipos son cruciales para comprender la
predisposición genética a enfermedades. Al identificar combinaciones específicas de
alelos asociadas con ciertas condiciones, se puede prever el riesgo genético y
desarrollar enfoques de prevención y tratamiento personalizados. Por otro lado,
también desempeñan un papel importante en la farmacogenómica, donde la
variabilidad genética entre individuos puede influir en la respuesta a medicamentos.
Comprender los haplotipos puede ayudar a adaptar tratamientos farmacológicos
según la predisposición genética de cada paciente.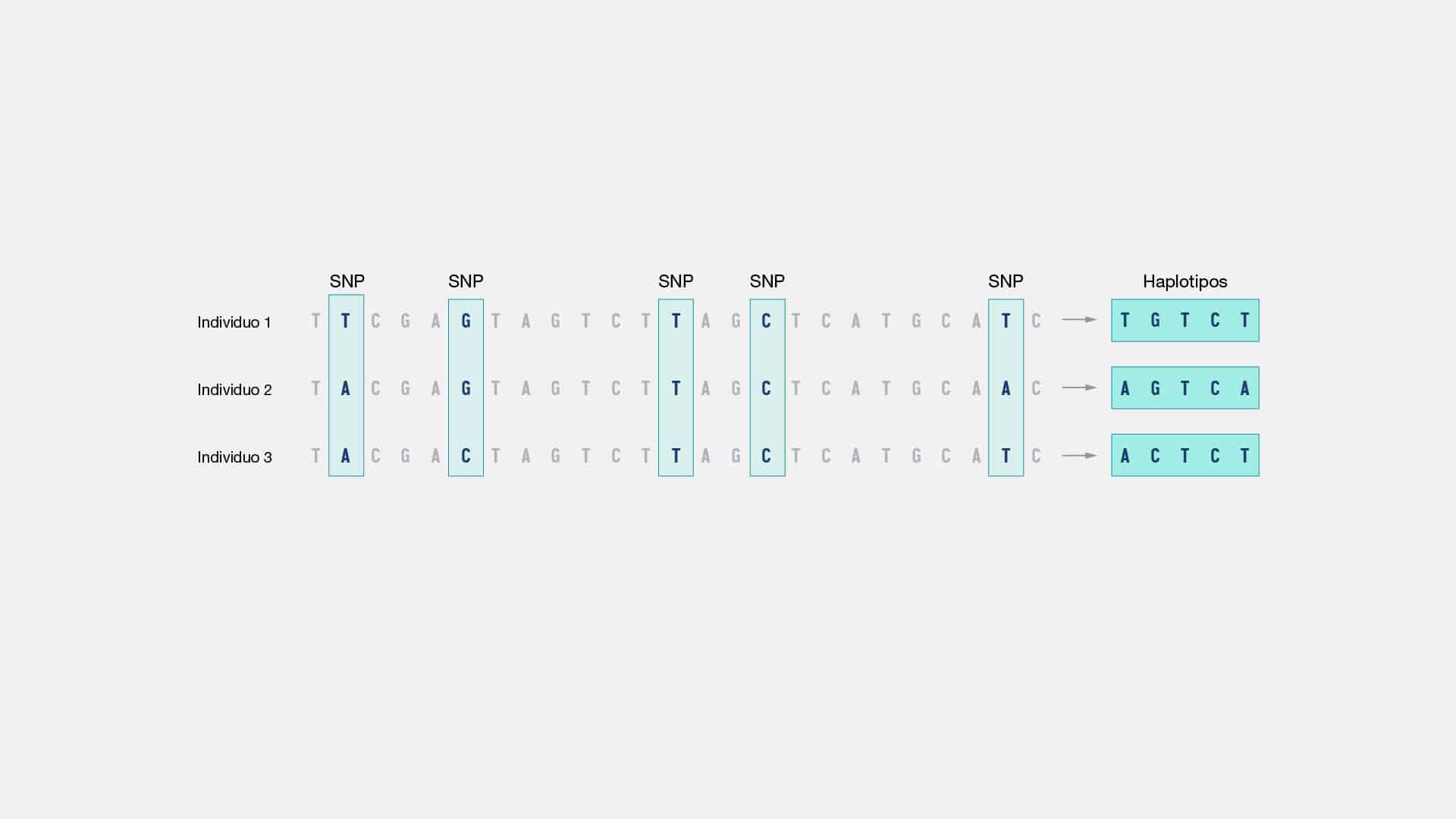

HapMap (mapa de haplotipos)
HapMap (mapa de haplotipos)
Imaginemos el HapMap (mapa de haplotipos) como el cartógrafo genético que
revela las rutas de variabilidad genética en poblaciones humanas, una obra maestra
que traza los paisajes genómicos que nos definen como especie.
Fundamentalmente, es un proyecto internacional que busca identificar y caracterizar
los haplotipos en el genoma humano, proporcionando un mapa detallado de la
diversidad genética.
En el escenario genómico, el HapMap captura la variabilidad en bloques de
haplotipos, permitiendo a los científicos comprender cómo estas variaciones
genéticas se distribuyen a lo largo de los cromosomas y cómo han evolucionado a lo
largo del tiempo. Al identificar patrones de variación en diferentes grupos étnicos, los
científicos pueden explorar migraciones humanas, mezclas genéticas y adaptaciones
evolutivas, enriqueciendo nuestra comprensión de la historia genómica de la
humanidad.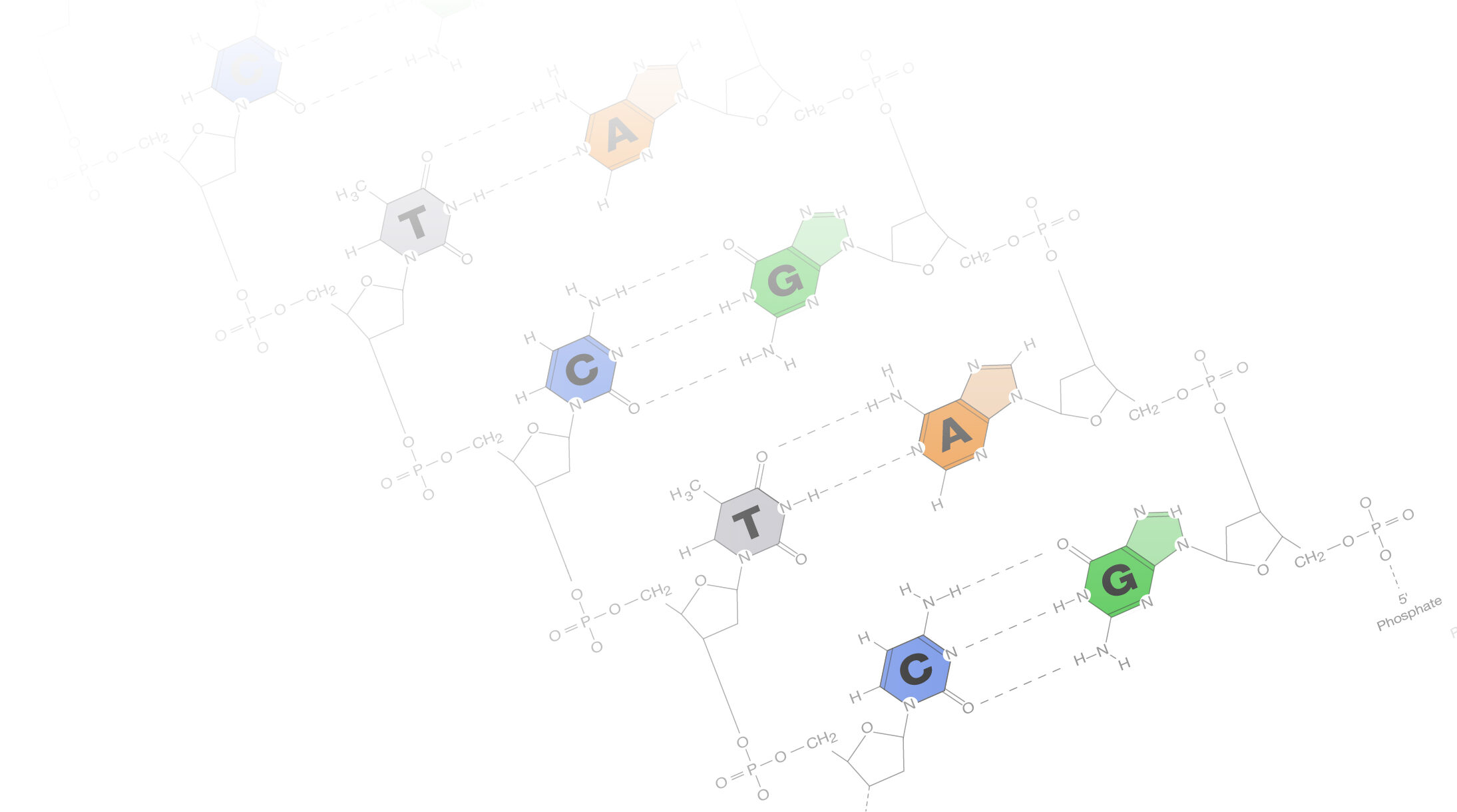

Hereditario
Hereditario
Pensemos en la herencia como el legado genético que se transmite de padres
a hijos, una sucesión de información biológica que esculpe nuestra identidad y
determina nuestros rasgos. En su esencia, es el proceso por el cual las
características genéticas son pasadas de una generación a la siguiente. Esta
transferencia de información contenida en los genes, puede determinar desde el
color de los ojos hasta la predisposición a ciertas enfermedades. La herencia
también está sujeta a diversos patrones que determinan cómo se expresan ciertos
rasgos en la descendencia; puede ser autosómica dominante, autosómica recesiva,
ligada al cromosoma X, entre otros.
Ahora bien, ¿dónde encontramos aplicaciones de este conocimiento? ¡En
todos lados! Desde la agricultura, donde se utilizan técnicas de mejoramiento
genético para desarrollar cultivos más resistentes y productivos, hasta la medicina,
donde se emplea el conocimiento genético para diagnosticar enfermedades
hereditarias y desarrollar terapias génicas.
¿Sabías que la herencia genética puede influir en aspectos más allá de las
características físicas? La predisposición genética a ciertos rasgos de personalidad,
habilidades cognitivas y susceptibilidad a trastornos mentales también tiene raíces
hereditarias.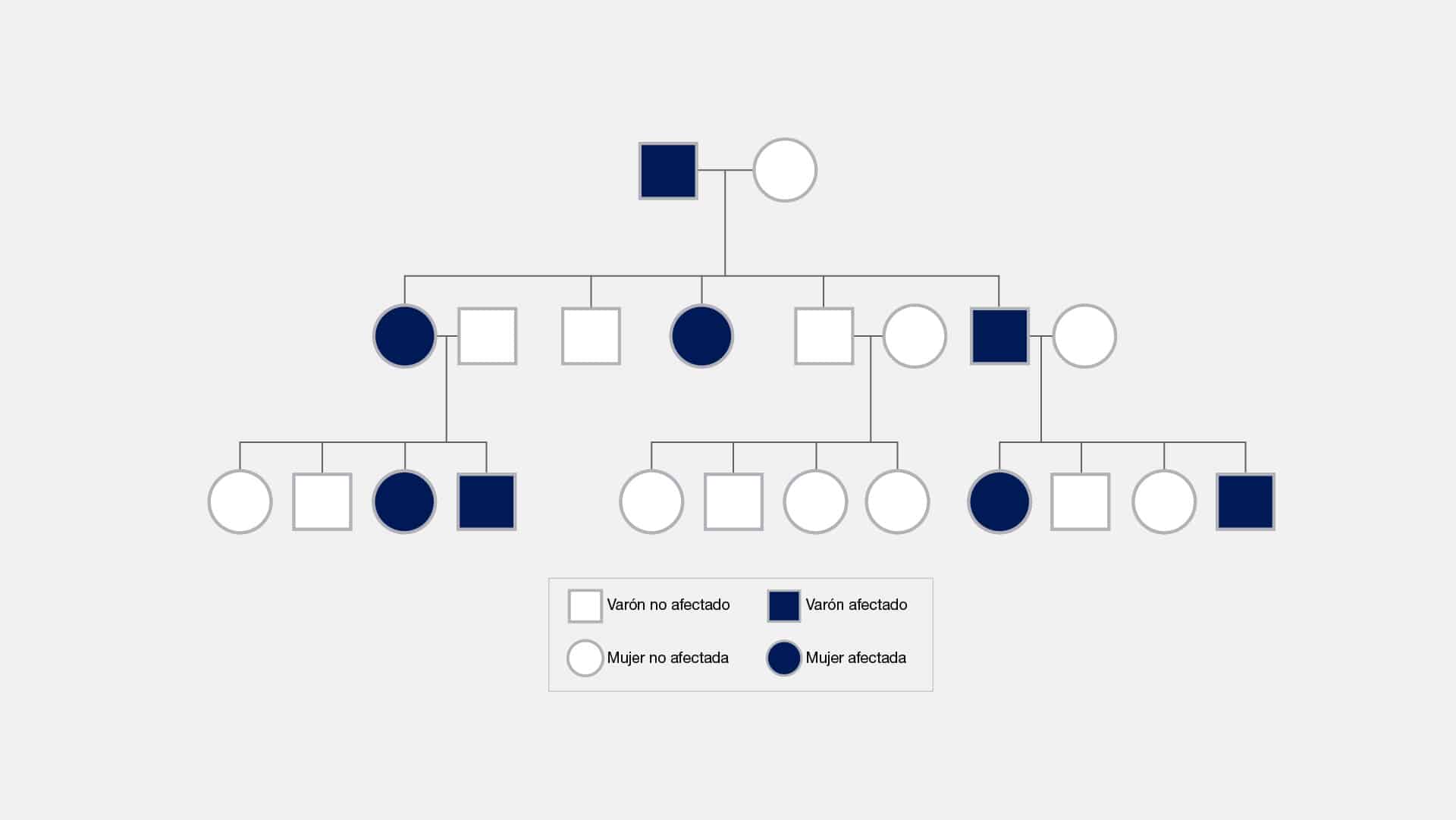

Herencia mendelina
Herencia mendelina
La herencia mendeliana se basa en las observaciones y experimentos pioneros realizados por Gregor Mendel en la década de 1860 con guisantes de
jardín. Mendel descubrió tres leyes fundamentales que gobiernan la transmisión de
rasgos de una generación a otra.
En el escenario genético, la herencia mendeliana se manifiesta a través de
las leyes de segregación y la distribución independiente de los alelos, que dictan
cómo ciertos rasgos se heredan y reparten durante la reproducción sexual, dando
lugar a la diversidad genética en las poblaciones.
Una característica estelar de la herencia mendeliana es la claridad de sus
patrones. Mendel estudió caracteres que seguían patrones de herencia simple,
donde un solo gen y sus alelos determinaban un rasgo específico. Esto facilitó la
identificación y comprensión de las leyes genéticas fundamentales.
Existen diversos campos de aplicación de estas leyes en el mundo real. En
agricultura, se utiliza para criar cultivos con características deseables, como mayor
rendimiento, resistencia a enfermedades o frutas y verduras de mejor sabor. En
medicina, la comprensión de la herencia mendeliana es fundamental para el
diagnóstico y tratamiento de enfermedades genéticas, permitiendo a los médicos
predecir el riesgo de padecer ciertas condiciones y diseñar terapias personalizadas.
Las pruebas genéticas basadas en las leyes de Mendel, permiten identificar
mutaciones en genes específicos que pueden estar vinculadas a condiciones
hereditarias.
Mendel, en su humildad, publicó sus descubrimientos en un oscuro periódico
científico, apenas recibiendo reconocimiento en su tiempo. Décadas después,
cuando otros científicos reavivaron su legado, el mundo reconoció la genialidad de
este modesto monje y su jardín de guisantes.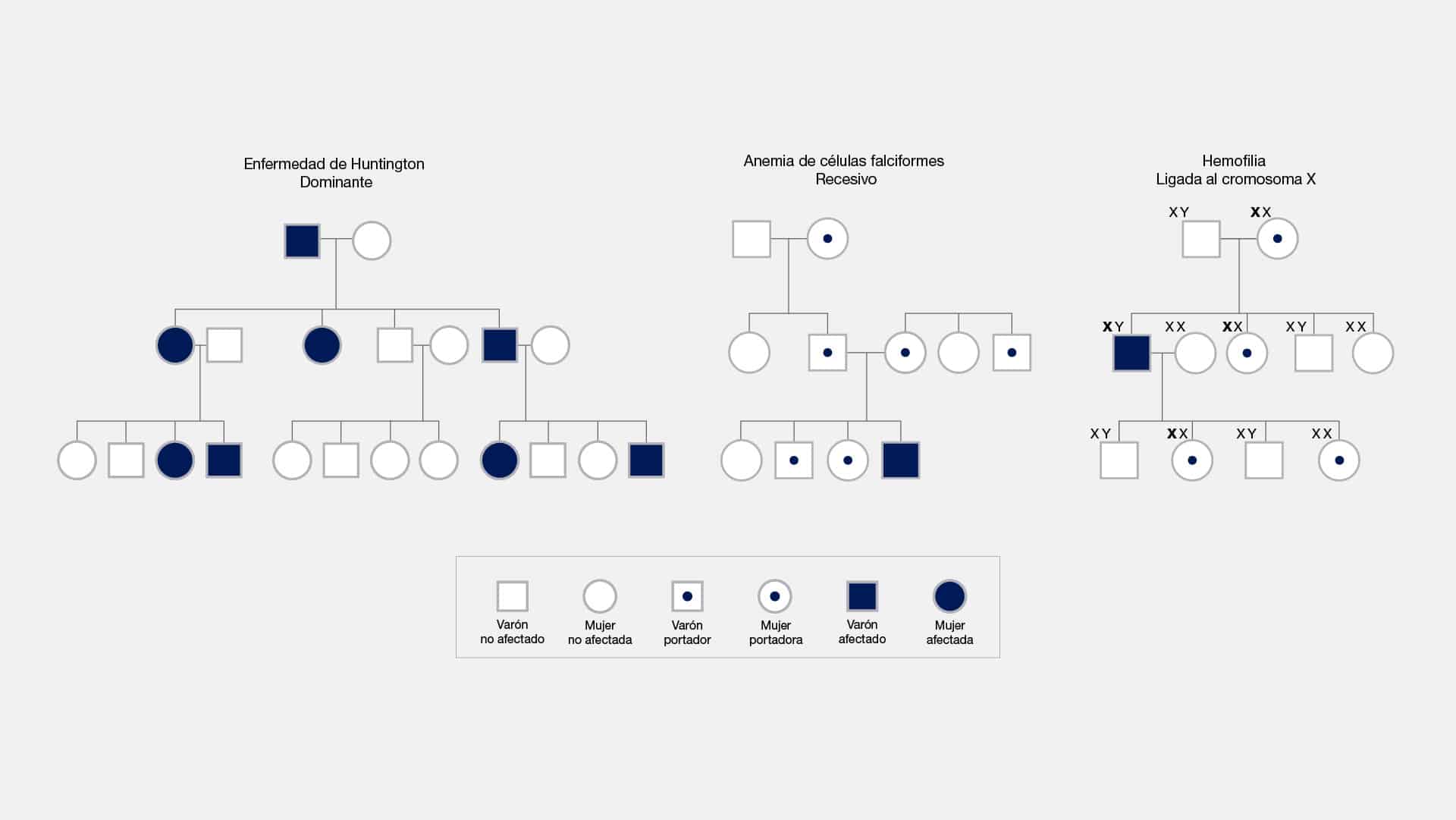

Heterocigoto
Heterocigoto
En términos sencillos, un heterocigoto se refiere a un organismo que posee
dos alelos diferentes para un gen específico en un par de cromosomas homólogos.
Esto significa que hay una combinación de alelos distintos en cada cromosoma, uno
proveniente del padre y otro de la madre.
El término "heterocigota" se opone al de "homocigota", donde ambos alelos
son idénticos. En la naturaleza, la diversidad genética generada por la heterocigosis
es fundamental para la evolución y la adaptación de las especies a su entorno
cambiante. La recombinación genética durante la reproducción sexual es un proceso
que promueve la formación de individuos heterocigotos, aumentando así la
variabilidad genética dentro de una población.
En cuanto a las aplicaciones, entender la heterocigosis es crucial en la cría
selectiva de plantas y animales para mejorar características deseables, como el
rendimiento de los cultivos o la resistencia a enfermedades. Además, en medicina, el
conocimiento de la heterocigosis es fundamental para comprender la herencia de
enfermedades genéticas y para el asesoramiento génico en familias con riesgo de
transmitir trastornos hereditarios.
En muchos casos, la descendencia de padres heterocigotos puede exhibir un
rendimiento fenotípico superior en comparación con la descendencia de padres
homocigotos. Este fenómeno, conocido como heterosis o vigor híbrido, destaca la
ventaja que tienen los individuos heterocigotos para una característica en particular.

Hibridacion ADN
Hibridacion ADN
Adentrándonos en el mundo de la biología celular, el concepto de hibridación
se explica como un baile molecular, donde dos moléculas complementarias de una
sola hebra de ADN y/o ARN se entrelazan para formar una molécula de doble
cadena. Esta unión se basa en el apareamiento preciso de las bases entre las dos
moléculas de una sola hebra.
Lo interesante de la hibridación es su capacidad para detectar, identificar y
cuantificar secuencias específicas de ADN en una muestra compleja. Esta técnica
permite explorar el ADN de una forma precisa y sofisticada, abriendo puertas a una
variedad de aplicaciones en diferentes campos.
En los ámbitos de la investigación y el laboratorio clínico, la hibridación
emerge como un proceso fundamental en diversas técnicas, donde se utiliza para
crear sondas de ácidos nucleicos, herramientas vitales que permiten sondear la
presencia o ausencia de moléculas de ADN o ARN específicas dentro de la célula.
También tiene aplicaciones en medicina, biotecnología, ciencias forenses y
agricultura, entre otros campos. Por ejemplo, se puede utilizar para diagnosticar
enfermedades genéticas e identificar patógenos en muestras clínicas.

Hibridacion biologica
Hibridacion biologica
En el escenario biológico, la hibridación se manifiesta cuando individuos de
diferentes poblaciones, razas o especies se cruzan, creando descendencia que
hereda genes de ambas líneas parentales. Esta mixtura genética puede resultar en
una nueva variedad con características intermedias o incluso novedosas, ofreciendo
a la naturaleza un lienzo para la experimentación evolutiva.
Si hablamos de hibridación no podemos dejar de mencionar papel crucial en la
generación de diversidad genética. A través de este fenómeno, la variabilidad se
introduce en poblaciones, lo que puede ser decisivo para la adaptación a cambios
ambientales y la supervivencia a largo plazo de especies. Sin embargo, la hibridación
puede ser un fenómeno complejo, donde no siempre es evidente el resultado del
cruce. Algunos híbridos pueden presentar ventajas adaptativas, mientras que otros
pueden ser menos aptos para sobrevivir en su entorno.

Hibridación fluorescente in situ (FISH)
Hibridación fluorescente in situ (FISH)
Imaginemos la técnica de hibridación fluorescente in situ (FISH, por sus siglas
en inglés), como el artista que pinta con luz en el lienzo de las células, revelando la
ubicación y la presencia de secuencias determinadas de ADN o ARN. En su esencia,
es una técnica de citogenética molecular que utiliza sondas fluorescentes para
identificar y visualizar secuencias genéticas específicas dentro de las células.
En el escenario microscópico, la técnica FISH despliega su encanto al permitir
a los científicos observar la disposición espacial de los genes y distintas moléculas.
Las sondas fluorescentes actúan como pinceles luminosos, resaltando regiones
precisas del material genético con colores brillantes. Su versatilidad es su
característica estelar, dado que puede utilizarse para visualizar genes específicos,
contar el número de cromosomas en una célula, detectar anomalías genéticas y
hasta rastrear la expresión de genes en tiempo real. Cuando el objetivo es identificar
genes específicos, las sondas se diseñan para que se unan a secuencias
particulares dentro del ADN o ARN de interés. Por otro lado, cuando se utilizan para
marcar cromosomas, las sondas están diseñadas para que se unan a secuencias
repetitivas que están presentes en regiones determinadas de los cromosomas,
permitiendo así un análisis citogenético detallado.
En la medicina, es esencial para el diagnóstico de enfermedades genéticas y
la detección de anomalías cromosómicas. Mientras que en la investigación científica,
ha sido clave para explorar la organización tridimensional del genoma en el núcleo
celular. El uso de esta técnica es una herramienta vital para comprender cómo la
disposición espacial de los genes puede influir en la regulación génica y la función
celular.
¿Sabías que la técnica FISH también puede ser utilizada en la identificación
de microorganismos en muestras ambientales? Al marcar específicamente el ADN de
ciertos microorganismos con sondas fluorescentes, los científicos pueden estudiar la
diversidad microbiana en entornos como suelos o aguas. Además, ha sido aplicada a
la astrobiología para buscar vida microbiana en lugares extremos de nuestro propio
planeta, como ambientes volcánicos o lagos salinos. Esta técnica brilla no solo en el
laboratorio, sino también, en la búsqueda de vida más allá de nuestras fronteras.
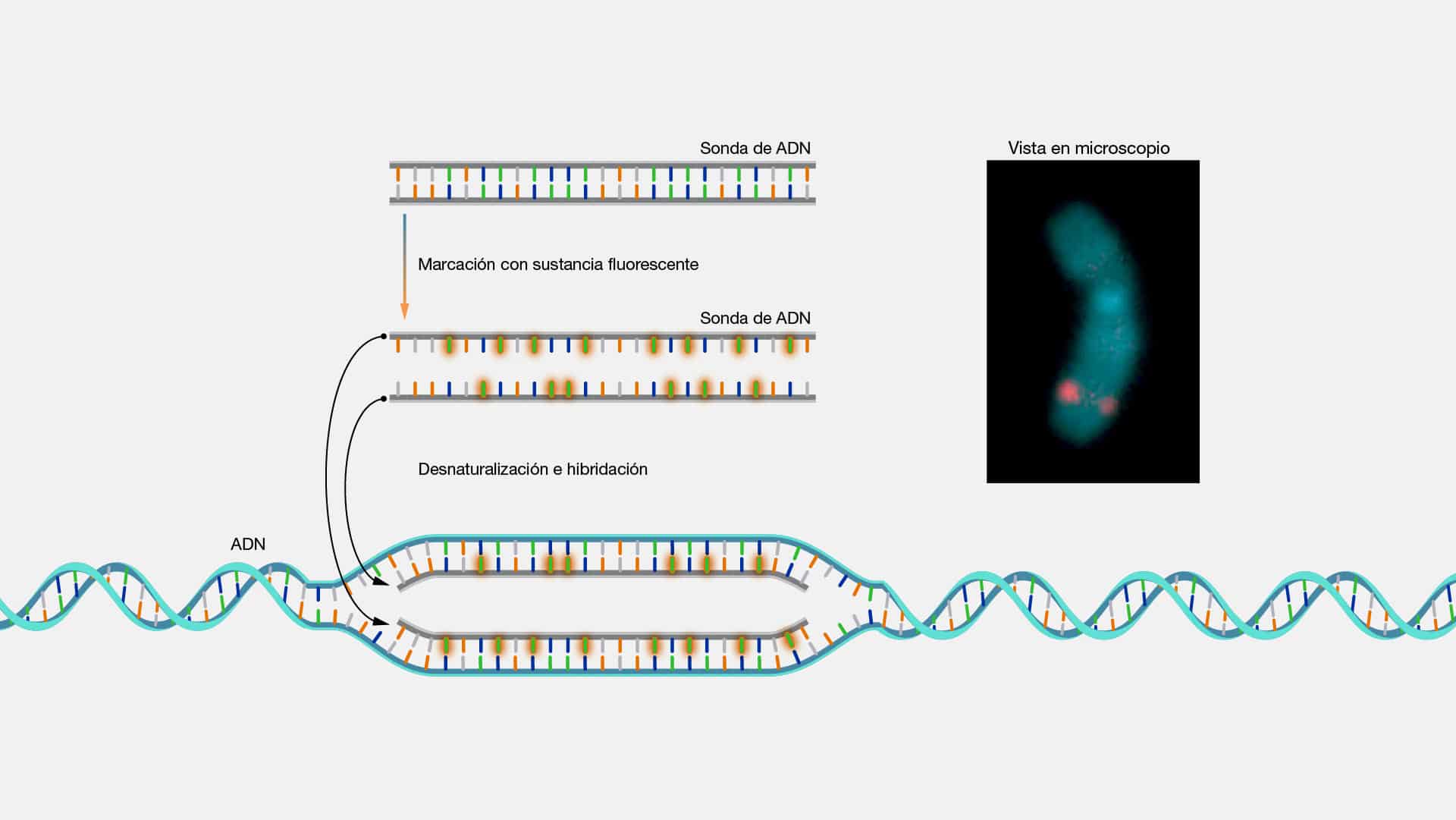

Hibridacion in situ
Hibridacion in situ
Imaginemos por un momento que poseemos una ventana mágica, una lente
que nos permite espiar en el interior de una célula y observar cómo los genes se
expresan, interactúan y de qué manera determinan el destino de un organismo. Este
es precisamente el poder de la hibridación in situ, ya que nos brinda la capacidad de
visualizar la actividad genética en su contexto natural, sin perturbar el delicado
equilibrio de la célula. En su esencia, es una técnica que utiliza sondas marcadas
con colorantes o radioisótopos, para hibridar y detectar secuencias complementarias
en el interior de las células, proporcionando así, información valiosa sobre la
localización y distribución de genes o ARN.
Una de las virtudes más valiosas de la hibridación in situ es su capacidad para
mantener la estructura celular intacta durante el proceso, permitiendo observar la
localización precisa de las moléculas diana. Esta técnica puede llevarse a cabo
utilizando diferentes tipos de sondas, desde sondas de ADN o ARN hasta
oligonucleótidos marcados con fluoróforos. La elección de la sonda adecuada
permite adaptar la técnica a diferentes propósitos y necesidades experimentales.
En la investigación científica y médica, se ha convertido en una herramienta
esencial para estudiar la expresión génica y la localización de genes específicos. Por
ejemplo, puede utilizarse para detectar la presencia de ciertos genes en muestras de
tejido, identificar células que expresan determinadas proteínas o incluso estudiar la
distribución espacial de ARN en el desarrollo embrionario. Por otro lado, en el
diagnóstico médico, la hibridación in situ ha revolucionado la detección de anomalías
genéticas y la identificación de células cancerosas, donde suele aplicarse para
evaluar la amplificación de genes relacionados con el cáncer en biopsias tumorales.
Es importante destacar que esta técnica no se limita solo a estudios en
humanos; ha sido aplicada en la investigación de plantas, animales y
microorganismos, permitiendo explorar la diversidad genética en muchísimas
especies.

Histona
Histona
Pensemos en las histonas como los andamios que sostienen y organizan la
gran información contenida en nuestros genes. Estas proteínas maravillosamente
compactas se envuelven alrededor del ADN formando complejos estructurales
conocidos como nucleosomas. Su función principal es regular el acceso y la
expresión del ADN, actuando como directores de escena que determinan qué partes
de la trama genética se representan y cuáles permanecen ocultas.
En el escenario microscópico, las histonas desempeñan el papel crucial de
embalar y organizar nuestro ADN en una estructura tridimensional. Los nucleosomas,
compuestos por histonas y el ADN enrollado a su alrededor, son los bloques
esenciales de la cromatina, esa maravillosa madeja de la que emergen las
instrucciones de la vida. Al modificar las histonas mediante procesos como la
acetilación o la metilación, se altera la accesibilidad del ADN, permitiendo o
bloqueando la lectura de determinados genes; lo que convierte a estas proteínas en
uno de los ejes fundamentales del control de la expresión génica.
En la investigación médica y farmacológica, se han desarrollado fármacos que
actúan sobre las histonas para modular la expresión génica en enfermedades como
el cáncer. Mientras que en la genética forense, el estudio de patrones de
modificaciones en estas proteínas, puede utilizarse para identificar y diferenciar
perfiles genéticos. Este enfoque proporciona una capa adicional de detalle en el
análisis de muestras biológicas, contribuyendo a la resolución de casos diversos.
¿Sabías que las modificaciones en las histonas pueden transmitirse de
generación en generación? Este fenómeno, conocido como epigenética, implica
cambios en la expresión génica que no alteran la secuencia de ADN pero que
pueden ser heredados, influenciando así la salud y la predisposición a enfermedades
en las generaciones futuras.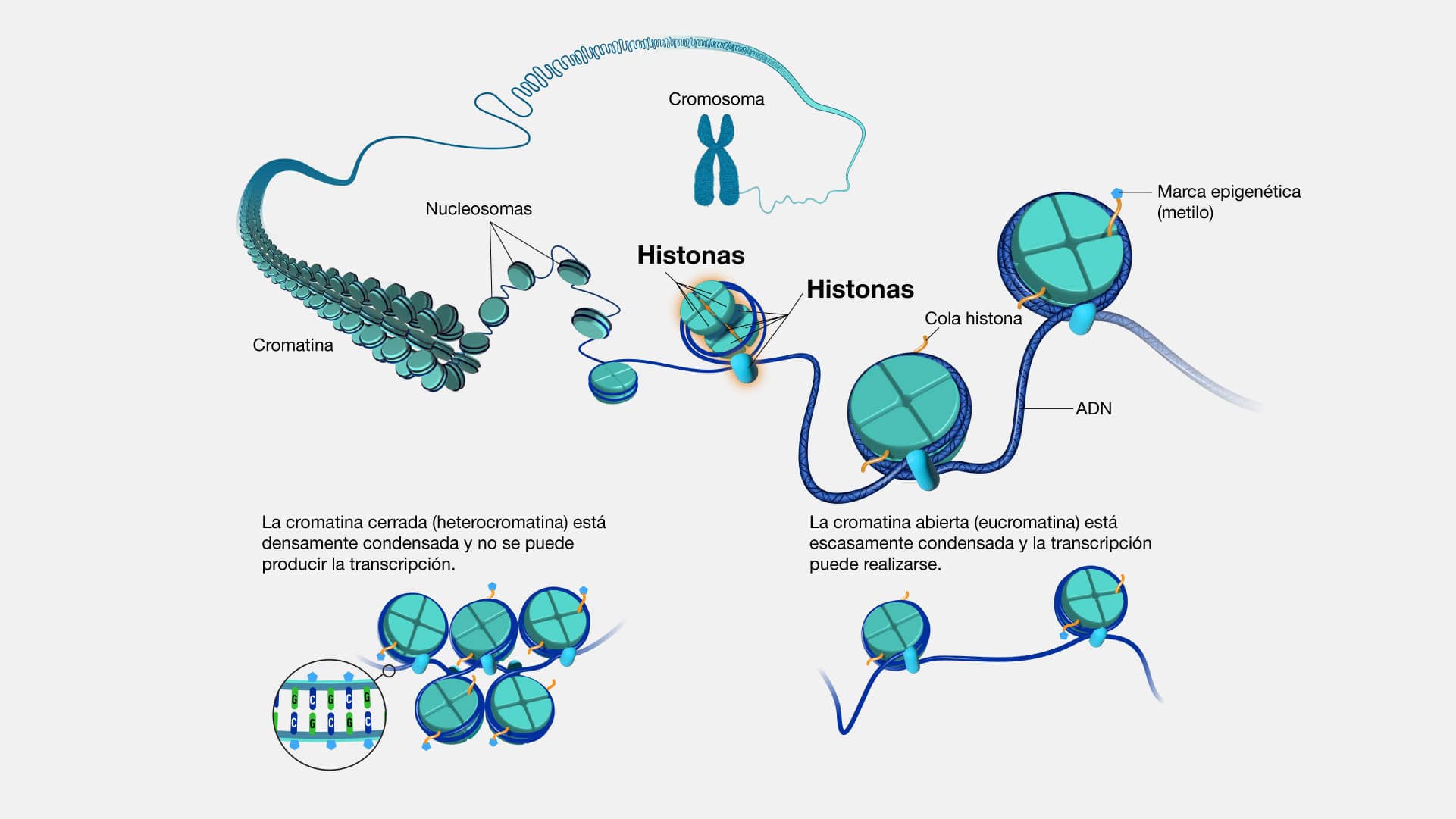

Homosigoto
Homosigoto
El homocigoto es aquel individuo que posee dos copias idénticas de un gen
específico en su ADN. En este enigmático mundo de la genética, donde las
combinaciones son infinitas, el homocigoto emerge como un ejemplar que lleva
consigo una versión pura, una sola variante de una historia genética. Por un lado, su
homogeneidad genética aporta una estabilidad en la expresión de un rasgo
particular, ya que ambos alelos trabajan en conjunto de manera idéntica. Sin
embargo, esta uniformidad puede revelar su vulnerabilidad frente a variantes
genéticas perjudiciales, ya que carece de un alelo de reserva que podría compensar
efectos negativos.
El homocigoto se destaca como un verdadero maestro en resaltar de manera
sobresaliente los rasgos hereditarios. Si un individuo es homocigoto para un alelo
dominante, la expresión clara de ese rasgo se convierte en su distintiva firma
genética. En contraste, al ser homocigoto para un alelo recesivo, revelará su carácter
específico asociado, ya que no existe un alelo dominante que eclipse su presencia.
En el campo de la medicina, la identificación de individuos homocigotos para
ciertas variantes genéticas puede ser crucial para determinar predisposiciones a
enfermedades hereditarias o para la selección de tratamientos farmacológicos más
efectivos. En la agricultura, el cultivo de plantas homocigotas para ciertos rasgos
deseables puede aumentar la productividad y la resistencia a enfermedades.
Alternativamente, en el mundo de la genética de poblaciones, la frecuencia de
homocigotos para ciertos alelos puede proporcionar información valiosa sobre la
historia y la demografía de una población.

Huella genetica
Huella genetica
La huella genética es como un sello distintivo inscrito en nuestras células, un
código único que nos distingue entre miles de millones de individuos. En su esencia,
es la composición genética particular de un ser vivo, una firma exclusiva que refleja
la combinación singular de sus genes.
En el escenario microscópico, la huella genética revela su magia en la
secuencia de nucleótidos que conforman nuestro ADN. Esta secuencia, es única
para cada individuo, incluso entre gemelos idénticos. Se construye a partir de
regiones específicas del genoma, como los microsatélites, que exhiben variaciones
en el número de repeticiones y contribuyen a la diversidad individual.
Su capacidad para la identificación y diferenciación entre individuos es la
pieza clave de su aplicación en diversos campos de estudio. En el ámbito forense, se
utiliza como una herramienta invaluable para resolver crímenes y establecer la
culpabilidad o inocencia de un individuo. La comparación de muestras de ADN
encontradas en la escena del crimen con las huellas genéticas de posibles
sospechosos permite una identificación precisa. Por otro lado, en la medicina,
contribuye a la personalización de tratamientos y a la identificación de
predisposiciones genéticas a ciertas enfermedades.
¿Sabías que la huella genética también puede revelar aspectos de nuestra
historia evolutiva? Estudios genéticos poblacionales han utilizado las huellas
genéticas para rastrear migraciones humanas y entender la diversidad genética en
diferentes regiones del mundo.

I
Idiograma
Idiograma
Los idiogramas son representaciones gráficas de los cromosomas de un
individuo, mostrando su disposición y sus características morfológicas, como la
longitud y la posición del centrómero. Cada cromosoma tiene un aspecto único, como
una pieza de rompecabezas que encaja perfectamente en el panorama general de
nuestra herencia genética.
Su característica principal es su capacidad para revelar anomalías
cromosómicas. El análisis de estas representaciones visuales permite identificar
pérdidas, ganancias o translocaciones, proporcionando información crucial para el
diagnóstico de enfermedades genéticas.
En la genética clínica, el idiograma es una herramienta esencial para el
diagnóstico de trastornos cromosómicos como el síndrome de Down, donde la
observación de un cromosoma extra en la posición 21 confirma la presencia de esta
condición. En otros ámbitos, como en la investigación biomédica, se utiliza para
estudiar la variabilidad cromosómica entre especies y comprender la evolución
genómica.

Impronta genetica
Impronta genetica
La impronta genética es como un sello secreto en nuestro ADN, una marca
que distingue entre las contribuciones genéticas maternas y paternas. En su esencia,
es un fenómeno epigenético donde ciertos genes son silenciados o expresados de
manera diferente según si provienen del óvulo o del espermatozoide. Mientras que
algunos genes pueden ser "apagados" por la impronta en el cromosoma materno, a
otros le ocurre lo mismo en el cromosoma paterno. Esta danza de activación y
silenciamiento crea un patrón único de expresión génica que contribuye a la
diversidad y complejidad de la herencia.
Una característica estelar de la impronta genética es su papel en el desarrollo
embrionario. La expresión diferencial de genes improntados influye en la formación
de tejidos y órganos, contribuyendo a la especificidad de cada individuo.
En el campo de la medicina reproductiva, la impronta genética puede
proporcionar información crucial sobre la salud y el desarrollo del embrión. Por
ejemplo, el estudio de los genes improntados puede ayudarnos a comprender mejor
las causas de ciertas enfermedades genéticas y anomalías del desarrollo, como el
síndrome de Angelman y el síndrome de Prader-Willi. También tiene aplicaciones
potenciales en el diagnóstico y el tratamiento del cáncer. Recientemente se ha
descubierto que la desregulación de los genes improntados está involucrada en
varios tipos de cáncer, lo que sugiere que podrían servir como biomarcadores útiles
para la detección temprana y el pronóstico de la enfermedad.

Ingeniera genetica
Ingeniera genetica
Podemos pensar en la ingeniería genética como un taller alquimista del siglo
XXI, donde los científicos manipulan los códigos genéticos para crear organismos
modificados genéticamente (OMG). En su esencia, es la aplicación de técnicas
moleculares para alterar la información genética de un organismo, ya sea para
mejorar sus características o para dotarlo de nuevas habilidades.
En el escenario microscópico, la ingeniería genética despliega su magia al
aislar, modificar y reinsertar segmentos específicos de ADN. Estos segmentos
pueden ser tanto exógenos, provenientes de otras especies o fuentes externas
(como parte del proceso de creación de organismos transgénicos); como endógenos,
utilizando herramientas como CRISPR-Cas9 para la edición precisa de genes dentro
del genoma de un organismo.
Hoy en día, la ingeniería genética tiene una amplia gama de aplicaciones
prácticas. En la medicina, se utiliza para desarrollar terapias génicas que pueden
corregir enfermedades genéticas hereditarias al reemplazar genes defectuosos en
versiones funcionales. En la agricultura, se emplea para mejorar la productividad de
los cultivos, hacerlos más resistentes a enfermedades o condiciones ambientales
adversas, y para desarrollar variedades de alimentos con características
nutricionales mejoradas.
La primera aplicación comercialmente exitosa de la ingeniería genética fue la
producción de insulina humana recombinante en bacterias. Antes de esto, la insulina
utilizada para tratar la diabetes se obtenía a partir de páncreas de animales, lo que
presentaba limitaciones en términos de suministro y calidad.

Iniciado o cebados
Iniciado o cebados
Imaginemos por un momento al iniciador (también conocido como cebador o primer) como la chispa que enciende el fuego de la replicación del ADN, una molécula corta y específica que marca el inicio para la síntesis de nuevas cadenas
de este ácido nucleico. Su rol principal consiste en unirse de manera precisa a una cadena de ADN existente, a partir de la cual se iniciará la replicación. Estas moléculas cortas son esenciales para asegurar que la ADN polimerasa pueda
comenzar a replicar el ADN de manera eficiente. Su especificidad garantiza la fidelidad en la transmisión de la información genética.
En la biología molecular, se utilizan en técnicas como la reacción en cadena
de la polimerasa (PCR), donde amplifican segmentos específicos de ADN. Estos
iniciadores personalizados permiten la replicación selectiva de regiones genéticas de
interés. También son de gran utilidad en la secuenciación del ADN, donde
desempeñan un papel crucial al marcar el comienzo de la lectura de la secuencia,
permitiendo la generación de datos precisos y completos.
¿Sabías que los iniciadores son sintetizados artificialmente en el laboratorio?
Esta capacidad para diseñar iniciadores específicos ha revolucionado la forma en
que estudiamos y manipulamos el material genético.

Insercion
Insercion
La inserción es el proceso mediante el cual segmentos de ADN son
incorporados en el genoma de un organismo, alterando su composición genética de
manera específica y controlada. En el escenario microscópico, la inserción despliega
su magia al integrar con precisión nuevos fragmentos de ADN en la secuencia
genómica. Este fenómeno puede ocurrir de manera natural, mediado por elementos
móviles como transposones, o ser inducido en el laboratorio para modificar genomas
con propósitos específicos.
Una característica indiscutible de la inserción es su capacidad para ser
direccionada. Los científicos pueden diseñar secuencias de ADN específicas,
conocidas como vectores, para insertar genes deseables en lugares precisos del
genoma, abriendo un vasto abanico de posibilidades en la ingeniería genética.
Las inserciones cromosómicas pueden tener consecuencias importantes para
la salud, ya que pueden interferir con la expresión normal de los genes cercanos al
sitio de inserción. Por lo tanto, el estudio de dichas inserciones es crucial para
comprender las bases genéticas de enfermedades hereditarias y para el diagnóstico
de trastornos genéticos. Por otro lado, en la investigación biomédica, la inserción se
utiliza en la creación de organismos modificados genéticamente (OMG) con fines
terapéuticos. Por ejemplo, en la terapia génica, se pueden insertar genes corregidos
en células afectadas por enfermedades genéticas para restaurar funciones normales.

Interaccion genes-ambiente
Interaccion genes-ambiente
Imaginemos la interacción genes-ambiente como un diálogo sutil entre la
genética y las circunstancias que rodean a un organismo. En su esencia, es la
interacción dinámica entre los genes que heredamos y las experiencias que vivimos,
un ballet molecular que moldea nuestras características y determina nuestro destino
biológico.
La interacción genes-ambiente despliega su magia al influir en cómo los genes
se expresan y cómo respondemos a nuestro entorno. Esta conexión íntima crea una
red de influencias recíprocas, donde ambos elementos se moldean mutuamente.
Esta plasticidad permite que los organismos se adapten y evolucionen en respuesta
a cambios en su entorno.
En la investigación médica, la interacción genes-ambiente se explora para
comprender mejor las causas subyacentes de enfermedades complejas como la
diabetes, la obesidad y enfermedades neuropsiquiátricas. Comprender cómo los
factores genéticos interactúan con el estilo de vida y el entorno puede guiar
estrategias de prevención y tratamiento personalizadas. De la misma manera, en el
ámbito de la psicología, el estudio de esta interacción es clave para comprender la
predisposición genética a trastornos mentales y entender cómo las experiencias de
vida pueden modular estas influencias genéticas.
Es importante tener en cuenta que la interacción genes-ambiente no solo
afecta a los individuos, sino que también puede tener implicaciones a nivel evolutivo.
La presión selectiva ejercida por el entorno puede dar forma a la frecuencia de
ciertos genes en poblaciones a lo largo del tiempo.

Intron
Intron
Podemos imaginar a los intrones como los elegantes bailarines enmascarados
de una danza genética, presentes pero ocultos, aportando complejidad y matices a la
narrativa genómica. En su esencia, son segmentos de ADN no codificante que se
entrelazan en los exones, las regiones que codifican proteínas, en una secuencia
genética conocida como transcripción primaria.
En el escenario microscópico, los intrones son eliminados durante un proceso
conocido como splicing, donde se cortan y las regiones restantes (llamadas exones)
se unen para formar el ARN mensajero funcional. Una característica que hace únicos
a los intrones es su abundancia. A pesar de que no codifican proteínas, constituyen
una parte considerable del genoma en muchos organismos, desafiando nuestra
concepción simplista de la genética como un lenguaje lineal y directo.
En la investigación biomédica, la comprensión de los intrones ha llevado al
desarrollo de terapias génicas más precisas. Al manipular el splicing, los científicos
pueden modular la expresión génica, abriendo nuevas estrategias para tratar
enfermedades genéticas y diversos tipos de cáncer.
En los últimos años, se ha descubierto que algunos intrones no son solo "ruido
genético", sino que pueden desempeñar roles importantes en la regulación génica y
en la evolución de las especies. Algunos intrones participan en la creación de
variabilidad genética al influir en la recombinación de genes durante la reproducción.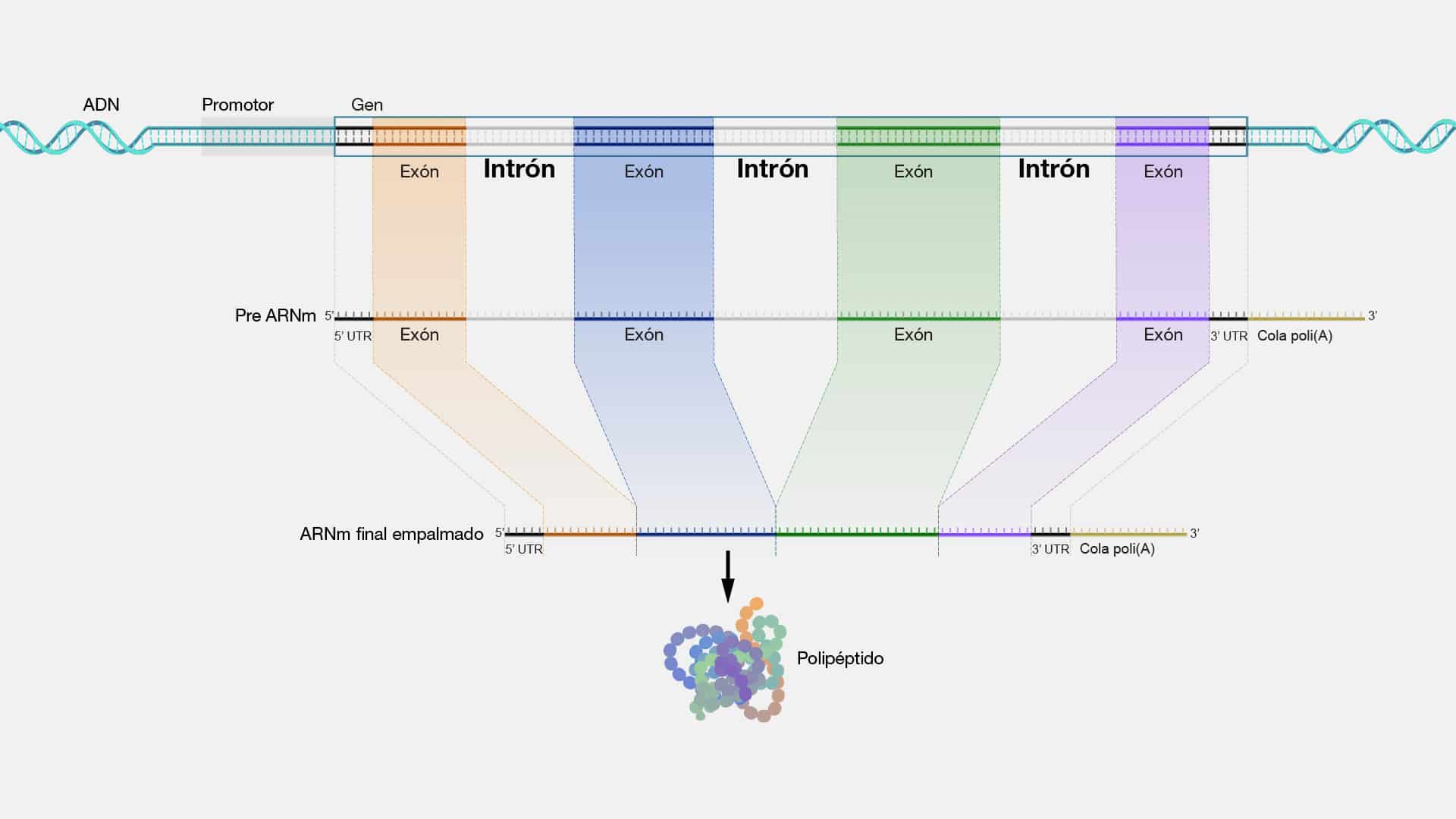

K
Knockout
Knockout
El knockout genético es una técnica que empuja los límites de la genética
experimental. Básicamente, implica desactivar o eliminar un gen específico para
estudiar los efectos que esta ausencia tiene en el organismo, revelando así las
funciones y conexiones genéticas. Este apagado selectivo de la expresión de un gen
puede lograrse mediante la introducción de mutaciones y/o la eliminación o la
introducción de fragmentos de ADN que inhiban la función normal del gen.
Caracterizado por su minuciosidad quirúrgica, puede lograrse de varias
maneras, pero una de las técnicas más revolucionarias es la edición génica mediante
CRISPR-Cas9. Este sistema de tijeras moleculares permite a los científicos dirigirse
con precisión a un gen específico y cortarlo, dejando una marca indeleble en el
código genético del organismo.
Desde estudios en modelos de ratón que revelan los misterios de
enfermedades humanas hasta la ingeniería de cultivos agrícolas más resistentes a
las plagas, el knockout genético ha expuesto secretos que de otro modo habrían
permanecido ocultos en el laberinto del ADN.
Esta técnica ha llevado a descubrimientos sorprendentes sobre la redundancia
funcional en los genomas. En algunos casos, la ausencia de un gen específico no
tiene un impacto drástico debido a la compensación por parte de otros genes,
revelando la complejidad y la flexibilidad de la biología.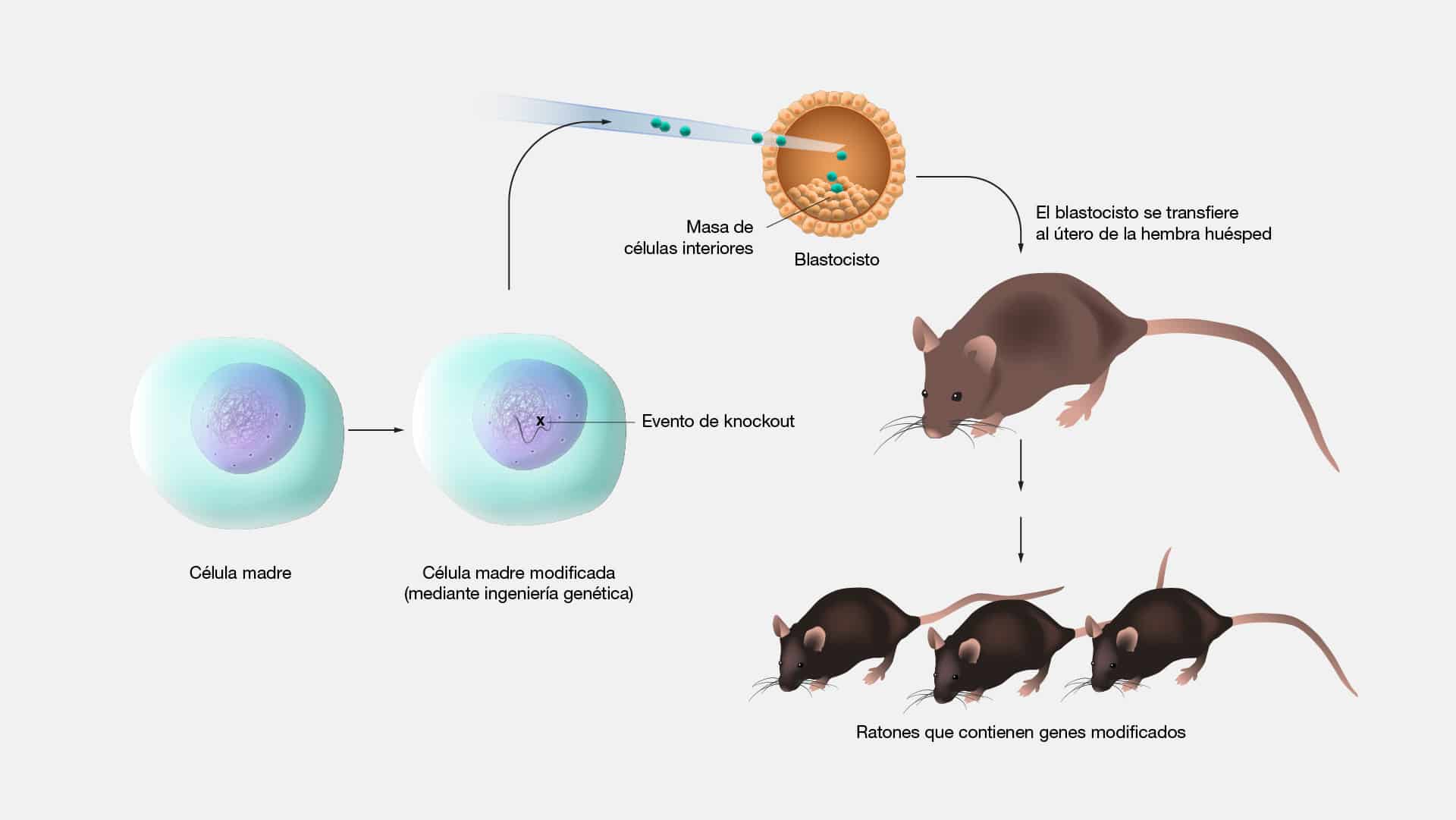

L
Ligado al sexo
Ligado al sexo
El término "ligado al sexo" se refiere a aquellos genes que residen en los
cromosomas sexuales y, por lo tanto, muestran patrones de herencia específicos
relacionados con el sexo de los individuos. En humanos, el par sexual está
representado por el cromosoma X y el Y. Mientras que las mujeres poseen dos
cromosomas X (XX), los hombres presentan un cromosoma X y un cromosoma Y
(XY). Es en esta diferencia donde yace la clave del fenómeno del ligamiento al sexo.
Una de las características más intrigantes de estos genes, es su patrón de
herencia. En el caso de los genes ligados al cromosoma X, las mujeres, pueden ser
portadoras de alelos recesivos sin manifestar la enfermedad, mientras que los
hombres, al tener solo un cromosoma X, expresarán cualquier alelo recesivo
presente en él. Esto puede llevar a una mayor prevalencia de ciertas enfermedades
ligadas al cromosoma X en hombres que en mujeres, como la hemofilia y la distrofia
muscular de Duchenne.
En el ámbito aplicado, el conocimiento sobre los genes ligados al sexo tiene
importantes implicaciones en la medicina, la reproducción asistida y la genética
forense. Por ejemplo, tanto en el campo médico como en la reproducción asistida , la
comprensión de la herencia ligada al sexo es crucial para el diagnóstico, la
prevención y el tratamiento de enfermedades genéticas. En genética forense, los
marcadores ligados al sexo pueden utilizarse para determinar el sexo de un individuo
a partir de muestras biológicas.
¿Sabías que el cromosoma Y, aunque más pequeño, lleva un peso
considerable en la determinación del sexo? Un solo gen en el cromosoma Y, llamado
SRY, desencadena una cascada de eventos que llevan al desarrollo de
características masculinas durante la gestación.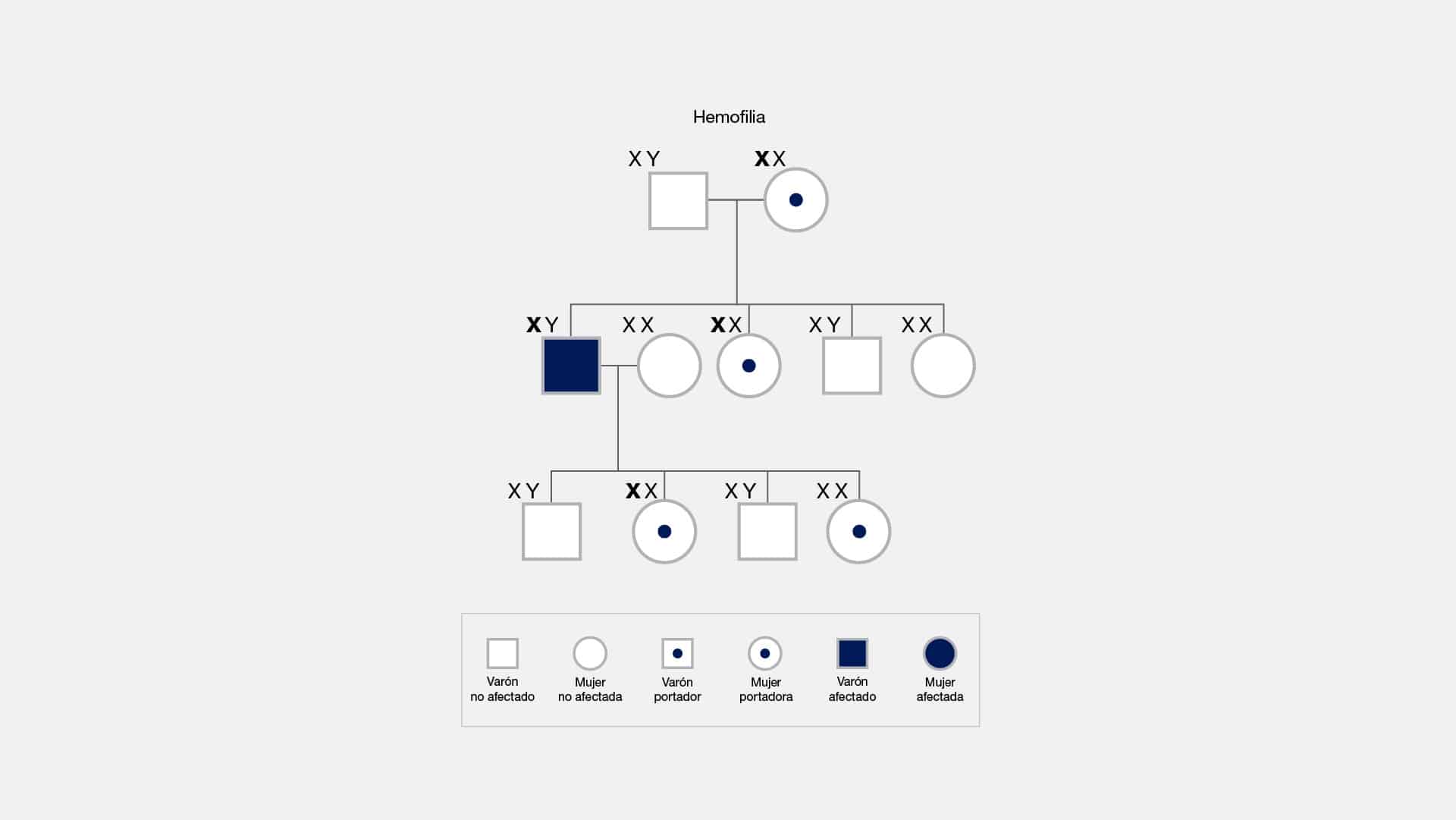

Ligado al X
Ligado al X
Los genes ligados al X son aquellos que residen en el cromosoma X y que
pueden tener implicaciones particulares en la herencia y la expresión génica. Las
mujeres, al tener dos cromosomas X, tienen dos copias de estos genes, mientras
que los hombres, con un cromosoma X y un cromosoma Y, tienen una sola copia.
Esto lleva a una dinámica genética peculiar y a la expresión diferencial de genes
ligados al X entre ambos sexos.
En los hombres, un solo gen en este cromosoma puede tener un impacto más
pronunciado, ya que no hay una segunda copia para compensar posibles
mutaciones. En cambio, las mujeres tienen una capacidad única para ser
"portadoras" de mutaciones en este tipo de genes. Debido a su doble dosis de
cromosomas X, una copia sana puede compensar la presencia de una copia
defectuosa, proporcionando una especie de "red de seguridad" genética. En este
contexto, pensemos en el daltonismo, una condición hereditaria que afecta la
percepción del color. El gen responsable del daltonismo está ubicado en el
cromosoma X, y su herencia sigue un patrón recesivo ligado al X. En consecuencia,
los hombres tienen mayor probabilidad de expresar el daltonismo si heredan el alelo
mutado, mientras que las mujeres, pueden ser portadoras sin manifestar la condición
en sí mismas.
En la investigación médica, comprender el estudio de genes ligados al X es
esencial para abordar enfermedades genéticas, y así desarrollar estrategias
terapéuticas y comprender la variabilidad de los síntomas. Por otro lado, en la
genética forense, el análisis de marcadores ligados al X ha demostrado ser útil en
casos donde se requiere identificación y reconstrucción de linajes familiares.
¿Sabías que los gatos calicó, esos felinos pintorescos con manchas de tres
colores contrastantes, son el resultado de la inactivación aleatoria del cromosoma X
en las células de las hembras? Este fenómeno, conocido como la hipótesis de Lyon,
añade un toque de misterio y belleza a la danza genética del cromosoma X.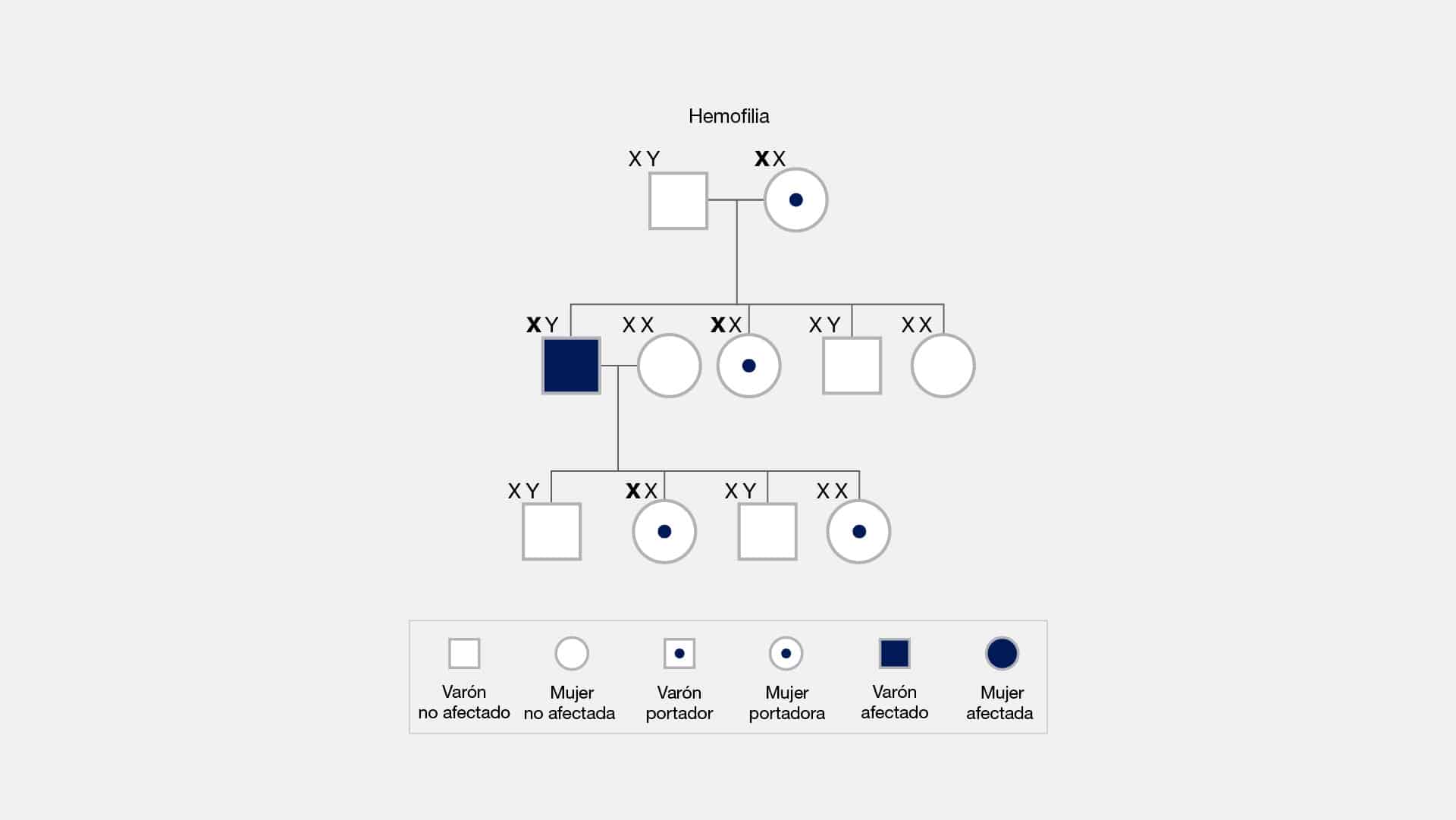

Ligamiento
Ligamiento
En el fascinante mundo de la genética, donde las cadenas de ADN se
entrelazan como hilos en un intrincado tejido, existe un concepto fundamental que
resalta entre el interior de los cromosomas: el ligamiento genético. Este fenómeno se
refiere a que dos o más genes se heredan juntos, es decir, permanecen unidos en un
mismo cromosoma y no se segregan independientemente durante la recombinación
genética.
Cuando dos genes están "ligados", suelen transmitirse juntos de una
generación a otra, creando patrones predecibles en la herencia genética. Cuando
esto sucede, la frecuencia con la que se recombinan estos genes está determinada
por la distancia física entre ellos en el cromosoma. Así, cuanto más cerca estén dos
genes en un cromosoma, menos probable es que se separen durante la meiosis y
más probable es que se hereden juntos. Su capacidad para romper la regla general
de la segregación independiente propuesta por Mendel, es la característica estelar
del ligamiento.
El estudio del ligamiento genético ha sido esencial en la cartografía de los
cromosomas y la identificación de genes asociados con enfermedades genéticas.
Por ejemplo, en el caso de la hemofilia, una enfermedad hemorrágica hereditaria, el
gen defectuoso está ligado a ciertos marcadores genéticos en el cromosoma X. Este
entendimiento ha permitido diagnósticos más precisos y estrategias de tratamiento
más efectivas. En la agricultura, entender el ligamiento genético ha sido esencial
para el mejoramiento de cultivos. Al identificar genes ligados que controlan
características deseadas, los criadores pueden seleccionar plantas con conjuntos
genéticos específicos para mejorar la producción y resistencia.
¿Sabías que el ligamiento genético también puede revelar curiosidades sobre
la evolución? Al estudiar el grado de ligamiento entre diferentes genes en
poblaciones, los científicos pueden inferir la historia evolutiva y las relaciones
genéticas entre especies. Es como rastrear los pasos de nuestros ancestros a través
de los patrones de herencia en el ADN.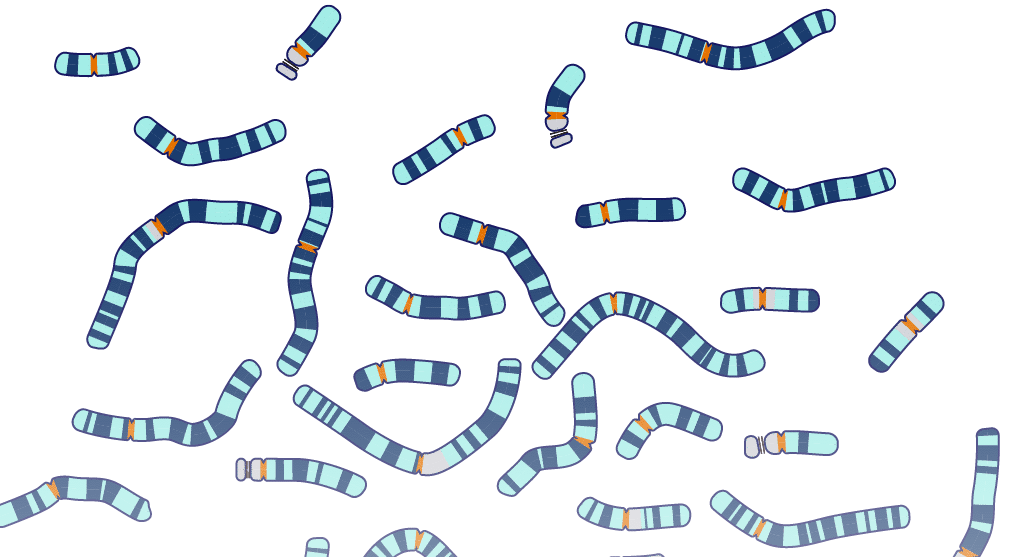

Linea germinal
Linea germinal
La línea germinal representa las células que dan origen a los gametos,
portadoras de la herencia genética que se transmite de padres a hijos. En el
escenario genético, despliega su majestuosidad en las células germinales (óvulos y
espermatozoides) que llevan consigo la carga genética única de un individuo.
Una característica a destacar, es la capacidad de la línea germinal para ser el
vehículo de la variabilidad genética. A través de procesos como la recombinación
genética, se generan combinaciones únicas de alelos en las células germinales,
asegurando que cada descendiente sea una mezcla exclusiva de los genes de sus
progenitores.
En la investigación médica, la comprensión de la línea germinal es crucial para
entender la heredabilidad de enfermedades genéticas y desarrollar estrategias de
prevención. En la agricultura, la manipulación de estas células es esencial para la
mejora genética de cultivos y ganado. Seleccionar individuos con características
deseables en sus células germinales permite desarrollar variedades que sean más
resistentes, productivas o adaptadas a condiciones específicas.
¿Sabías que la línea germinal también es susceptible a mutaciones
espontáneas? Aunque los sistemas de reparación del ADN son activos,
ocasionalmente pueden ocurrir cambios genéticos en las células germinales, dando
lugar a nuevas variantes que se transmiten a las generaciones futuras.

Locus
Locus
En su esencia, un locus es el lugar específico en un cromosoma donde reside
un gen particular, y es aquí donde la genética compone su sinfonía única. Cuando
nos referimos a más de un locus, el plural toma el nombre de loci.
Imaginemos un punto en el genoma, una dirección precisa donde reside un
fragmento de información genética. Este es el locus, una marca en el vasto lienzo del
ADN, donde una secuencia específica de nucleótidos cobra vida. Pero el locus no es
solo una ubicación estática, es un escenario dinámico donde los genes bailan al
ritmo de la evolución y la herencia. Caracterizado por su singularidad y relevancia,
cada locus alberga un gen o una secuencia de ADN con funciones distintivas que
moldean la fisonomía y el destino de un organismo. Diferentes versiones de un gen,
conocidas como alelos, pueden ocupar el mismo locus en cromosomas homólogos,
creando la riqueza genética que define la diversidad dentro de una población.
Identificar el locus de un gen asociado a una enfermedad permite a los
científicos desarrollar pruebas genéticas y estrategias terapéuticas dirigidas. En la
agricultura, el análisis de los loci es fundamental para la mejora de cultivos.
Seleccionar plantas con alelos específicos en ciertos loci puede mejorar
características como la resistencia a enfermedades o rendimiento, contribuyendo así
a la seguridad alimentaria.


M
Mapa fisico
Mapa fisico
Imaginemos el mapa físico como el atlas que revela los paisajes ocultos de
nuestro ADN, un compendio que nos permite navegar por los intrincados caminos de
los cromosomas. En su esencia, un mapa físico genómico es una representación
gráfica de la disposición de los genes y otros elementos en los cromosomas de un
organismo.
En este viaje cartográfico, cada "punto de referencia" es un marcador
genético, un faro que ilumina la ubicación precisa de un gen en un cromosoma. Los
marcadores genéticos, como los microsatélites o los SNPs, sirven como
coordenadas en este vasto paisaje genómico, permitiendo a los científicos trazar el
mapa con precisión. Su capacidad para evidenciar la distancia relativa entre genes y
otros elementos genéticos representa su característica estelar. Esta distancia se
mide en términos de "pares de bases", las unidades que componen la escalera de la
doble hélice del ADN. Esta información es esencial para comprender la organización
y la estructura del genoma.
Localizar genes específicos en el mapa facilita la investigación y el desarrollo
de terapias dirigidas para trastornos genéticos. En la agricultura, la cartografía
genómica contribuye a la mejora de cultivos. Identificar y mapear genes
responsables de rasgos deseables, como resistencia a plagas o mayor rendimiento,
ayuda a los agricultores a seleccionar variedades de cultivos más eficientes.
Las tecnologías modernas han llevado a la cartografía genómica a nuevas
alturas. Distintas técnicas avanzadas, como la secuenciación de nueva generación,
han permitido la creación de mapas genómicos de alta resolución, detallando incluso
las regiones más complejas del ADN.

Mapa genetico
Mapa genetico
Imaginemos el mapa genético como un atlas de la herencia, donde los genes
son las ciudades y pueblos, los cromosomas son los caminos que conectan estos
lugares, y el ADN es el tejido mismo de la geografía molecular. Este mapa no solo
nos muestra la disposición física de los genes en los cromosomas, sino que también
señala los marcadores genéticos, las variantes y las regiones de interés, iluminando
los caminos hacia la comprensión de la herencia y la variabilidad genética.
Concebido sobre los pilares del ligamiento genético, este mapa revela la proximidad
entre los genes en el cromosoma y la probabilidad de su herencia conjunta. Cuanto
más estrechamente entrelazados estén dos genes en este telar genético, mayor será
la probabilidad de que viajen juntos en el viaje de la herencia.
Una de las características más notables del mapa genético es su capacidad
para desentrañar la complejidad de la herencia humana. Desde los primeros mapas
genéticos rudimentarios trazados por pioneros como Thomas Hunt Morgan, hasta los
mapas de alta resolución generados por tecnologías de secuenciación de próxima
generación, hemos avanzado enormemente en la cartografía de nuestros propios
cromosomas. Estos mapas han sido fundamentales para identificar genes
responsables de enfermedades hereditarias, trazar la historia evolutiva de las
poblaciones humanas y comprender la base genética de rasgos complejos como la
altura, el color de la piel y la predisposición a enfermedades.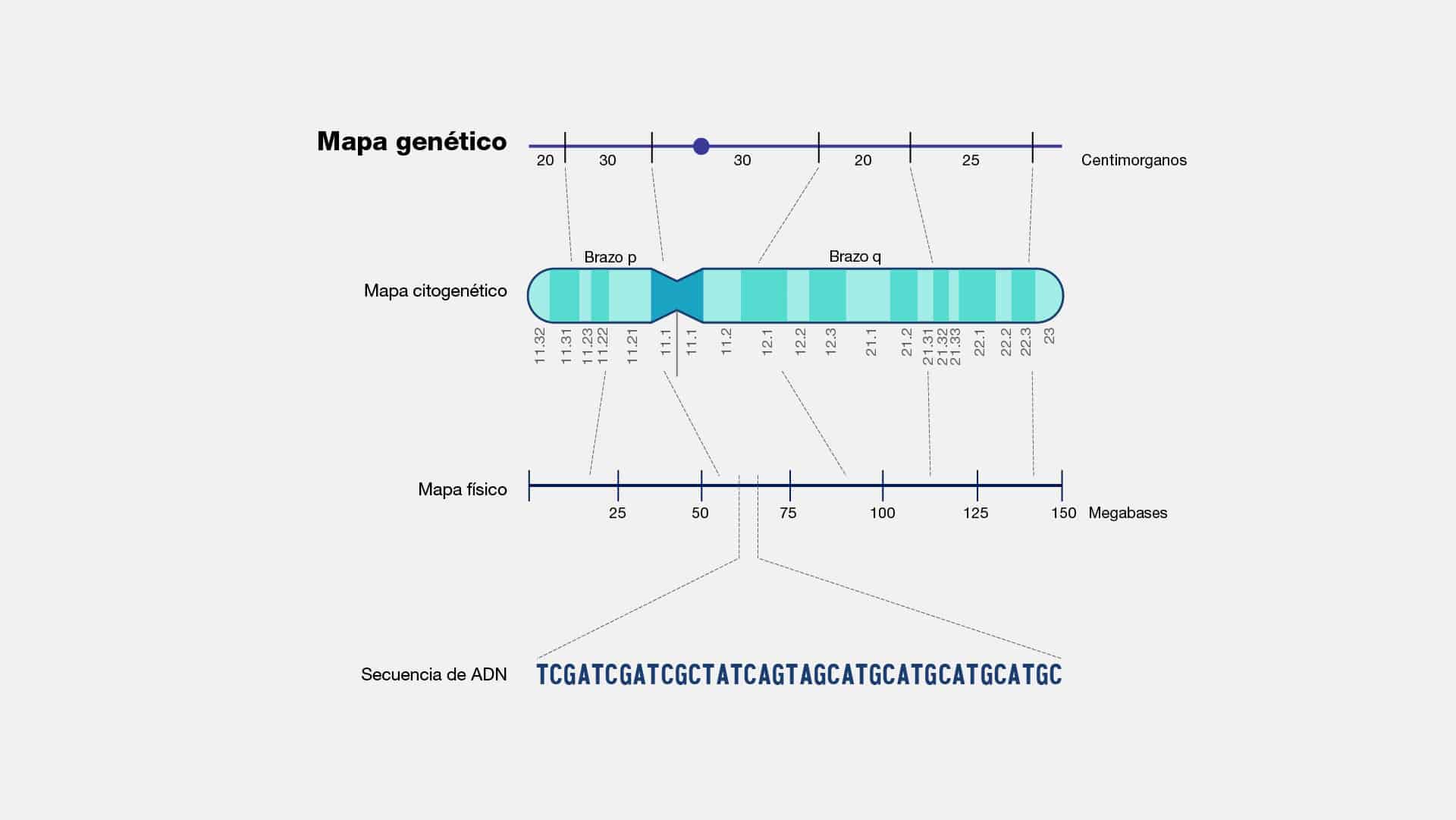

Marcador
Marcador
El marcador, en su esencia, es una herramienta ingeniosa utilizada por los
científicos para rastrear, identificar o medir ciertas características biológicas,
químicas o genéticas en organismos vivos. Dotados de una variedad de formas y
funciones, los marcadores actúan como faros luminosos en la oscuridad, guiando a
los investigadores hacia un entendimiento más profundo de los procesos vitales y las
interacciones en el mundo natural.
Hay ciertas características distintivas que explican la gran importancia de los
marcadores en la investigación. Son selectivos, capaces de señalar específicamente
lo que se busca, ya sea un gen particular, una proteína o un evento bioquímico
crucial. Además son sensibles, detectando incluso las más sutiles fluctuaciones en el
entorno biológico. Por último, pero no menos importante, son versátiles, adaptándose
a una amplia gama de aplicaciones científicas, desde el estudio de la evolución hasta
el diagnóstico médico.
En la genética, los marcadores moleculares como el ADN microsatélite o los
polimorfismos de nucleótido único (SNPs por sus siglas en inglés) son utilizados para
mapear genomas, estudiar la diversidad genética y rastrear la ascendencia humana.
En la neurociencia, los marcadores fluorescentes permiten la visualización en tiempo
real de procesos neuronales, revelando los misterios del cerebro en acción. En la
ecología, los marcadores isotópicos son empleados para seguir los movimientos de
las especies y comprender las complejas redes tróficas que sustentan la vida en los
ecosistemas
¿Sabías que los marcadores de carbono-14 han sido utilizados para datar
fósiles y reconstruir la historia antigua de la vida en la Tierra? ¿O que los marcadores
de expresión génica pueden revelar los secretos de la regulación genética y la
respuesta celular a estímulos ambientales? Incluso en el campo de la astronomía, los
marcadores espectrales nos permiten analizar la composición química de estrellas
distantes y galaxias lejanas, expandiendo nuestro entendimiento del cosmos.

Marco abierto de lectura
Marco abierto de lectura
Imaginemos al marco abierto de lectura como un libro cuyas páginas están
compuestas por los "tripletes de bases" del ADN. Cada triplete, llamado codón, actúa
como una palabra que, leída en el contexto de la secuencia, forma instrucciones para
la síntesis de proteínas. En el campo de la genómica, un marco abierto de lectura se
define como una sección de una secuencia de ADN que carece de un codón de
terminación, que es esencialmente una señal de parada. Los codones representan
unidades de información genética, codificando para un aminoácido específico o
indicando el final de la síntesis de proteínas. De los 64 codones diferentes, 61
especifican aminoácidos y 3 sirven como codones de terminación. Por lo tanto, un
marco abierto de lectura largo es comúnmente una parte de un gen, es decir, una
secuencia que codifica directamente una proteína.
Una característica destacada del marco abierto de lectura es su capacidad
para ser leído en tres direcciones: de izquierda a derecha, de derecha a izquierda o
en direcciones opuestas. Esta versatilidad permite a los científicos identificar
regiones de codificación de proteínas en el ADN.
En la investigación médica, su estudio es crucial para comprender la función
de genes específicos. Identificar y analizar estos marcos proporciona información
sobre las proteínas que producen y cómo estas contribuyen a la salud o a
enfermedades hereditarias. En la ingeniería genética, los científicos pueden
manipular marcos abiertos de lectura para introducir genes candidatos en
organismos, con aplicaciones que van desde la producción de medicamentos hasta
la mejora de características en cultivos.
¿Sabías que no todos los marcos abiertos de lectura codifican proteínas?
Algunos desempeñan funciones regulatorias o de señalización en lugar de servir
como instrucciones para la síntesis de proteínas, añadiendo una capa de
complejidad y versatilidad al lenguaje genético.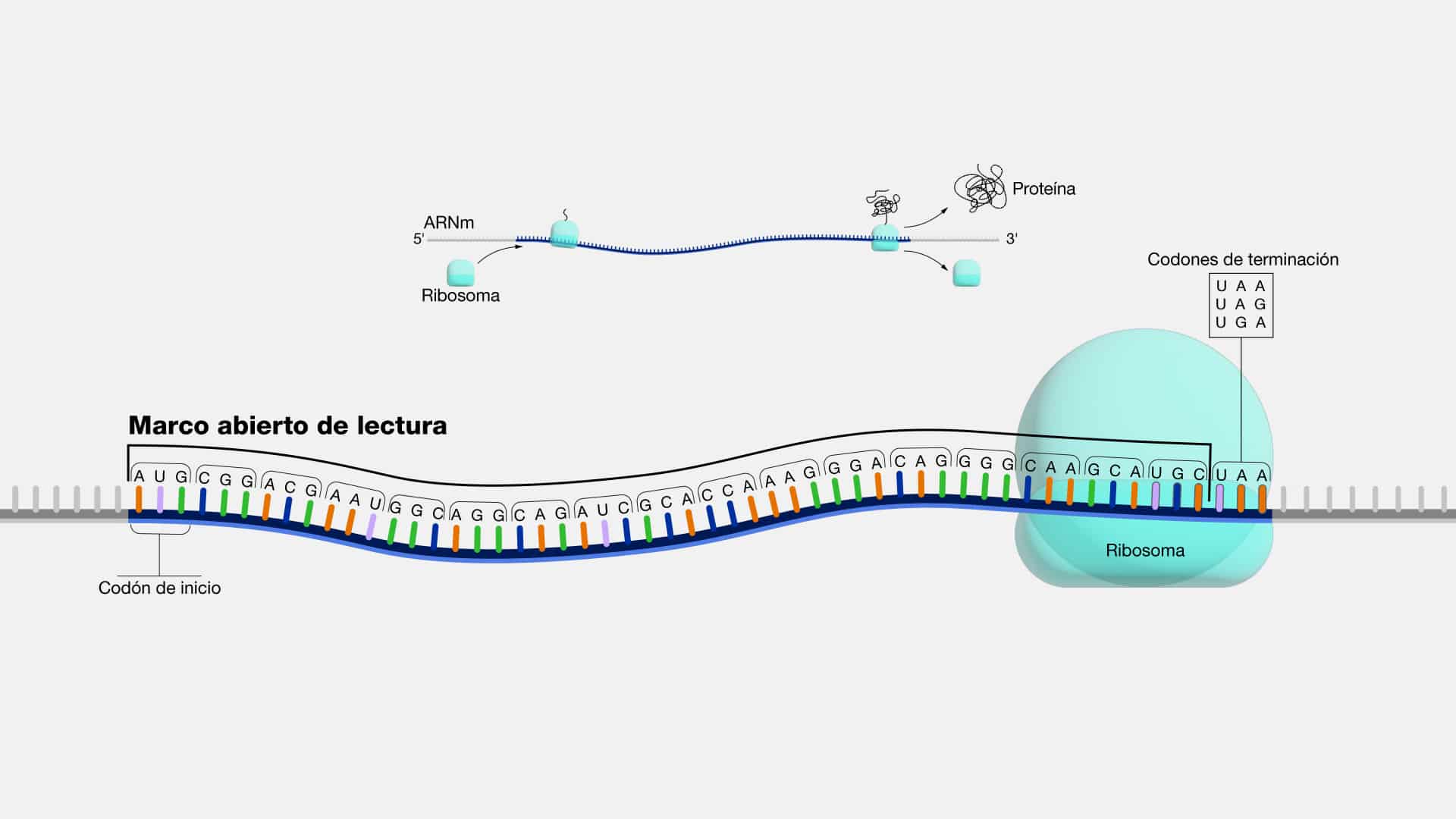

Meiosis
Meiosis
Visualicemos a la meiosis como un baile genético en dos actos, donde las
células germinales se transforman en células sexuales. En el primer acto, conocido
como meiosis I, las células germinales se dividen en dos células hijas, cada una con
la mitad del material genético original. Luego, en el segundo acto, la meiosis II, estas
células hijas se dividen nuevamente, generando un total de cuatro células sexuales,
cada una única en su composición genética.
Una característica destacada de la meiosis es el fenómeno de la
recombinación génica. Durante este proceso, segmentos de cromosomas homólogos
intercambian información genética, creando combinaciones únicas de alelos en las
células sexuales resultantes. En la reproducción sexual, la meiosis es el proceso que
da lugar a la formación de óvulos y espermatozoides. La variabilidad genética
generada por la recombinación aumenta la diversidad genética entre las
descendencias, contribuyendo a la evolución y adaptación de las especies.
En la investigación médica, el estudio de errores en la meiosis puede
proporcionar información sobre trastornos genéticos. Problemas en la segregación
cromosómica durante la meiosis pueden dar lugar a aneuploidías, como el síndrome
de Down.
¿Sabían que la meiosis es esencial para la creación de gametos con la mitad
del material genético? Esta reducción en la cantidad de ADN asegura que, cuando
los gametos se fusionan durante la fecundación, se restablezca el número completo
de cromosomas en el nuevo individuo.

Mellizos
Mellizos
Imaginemos un ballet genético donde la duplicidad asume el papel principal.
Los mellizos, también conocidos como gemelos dicigóticos, conforman un dúo de
individuos que comparten aproximadamente el 50% de su material genético. Este
intrigante fenómeno ocurre cuando dos óvulos diferentes son fecundados por dos
espermatozoides distintos durante la misma ovulación.
Los mellizos exhiben una característica distintiva: no son genéticamente
idénticos. Aunque comparten aproximadamente la mitad de sus genes, la
combinación específica de alelos que heredan puede diferir significativamente.
En el ámbito de la investigación médica, el estudio de estos individuos abre
una ventana fascinante para explorar la interacción entre la genética y el entorno.
Los estudios con mellizos han contribuido notablemente a nuestra comprensión de la
heredabilidad de ciertas condiciones, así como al impacto de los factores
ambientales en el desarrollo de enfermedades. Por otro lado, en el campo de la
psicología y la educación, los estudios con mellizos han permitido examinar la
influencia relativa de la genética y el entorno en rasgos como la inteligencia o la
personalidad. La comparación de mellizos criados en diferentes entornos proporciona
valiosas perspectivas sobre la interacción entre la genética y el ambiente en el
desarrollo humano.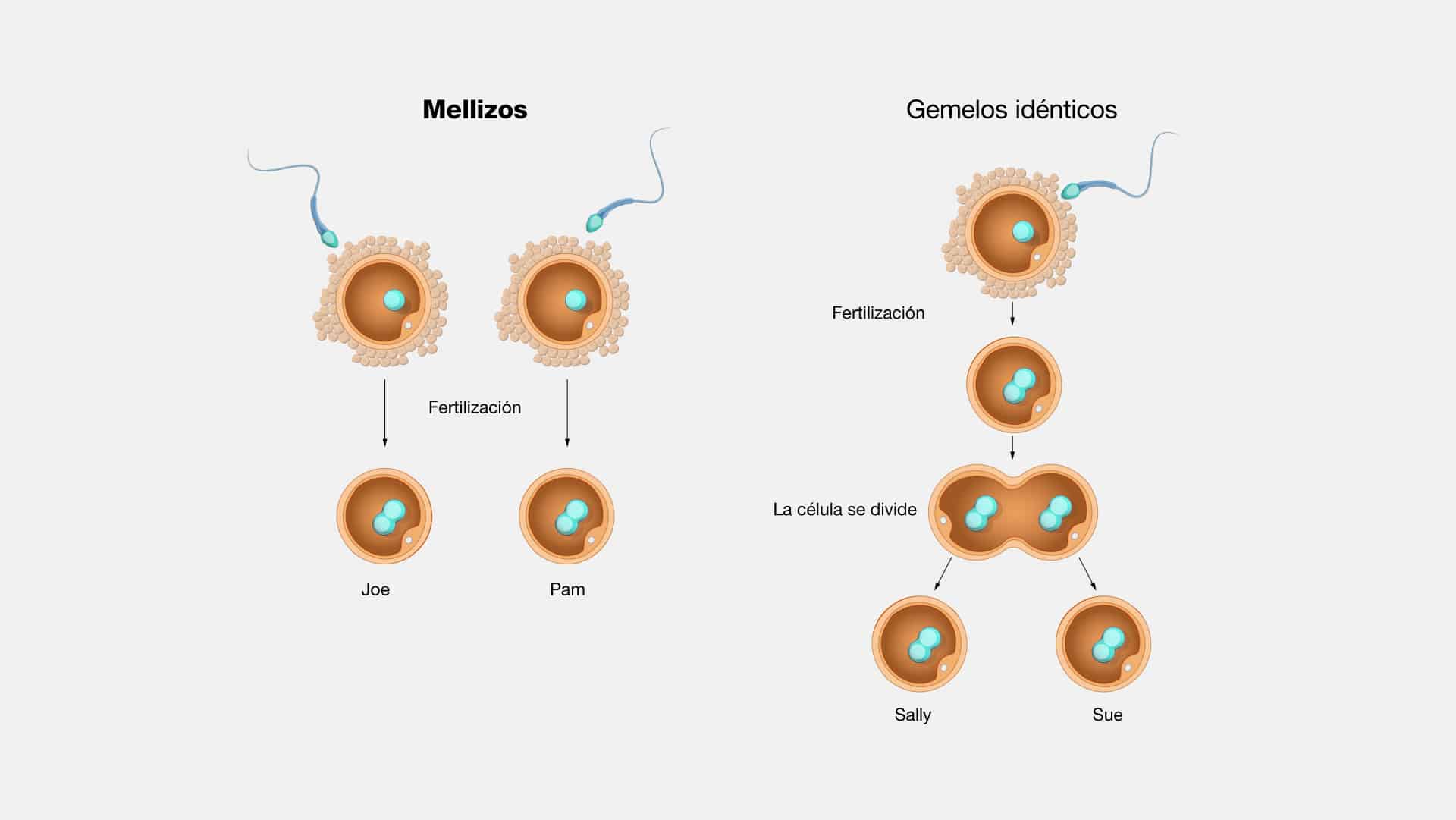

Membrana nuclear
Membrana nuclear
Si pensamos en la célula como un teatro, podemos imaginarnos a la
membrana nuclear como el telón que separa los actos. Es básicamente, una
estructura esencial que rodea y protege el núcleo, donde yacen los tesoros genéticos
codificados en el ADN. Sin embargo, no se trata solo de una barrera física; es una
coreógrafa maestra que regula el flujo de información genética. Esta membrana está
perforada por poros nucleares, pequeñas puertas que permiten el intercambio
selectivo de moléculas entre el núcleo y el resto de la célula. En otras palabras, los
poros son como complejas estaciones de control de pasaportes que regulan la
entrada y salida de moléculas según señales específicas. Este sistema de seguridad
molecular es vital para mantener la integridad del núcleo.
Una característica que distingue a la membrana nuclear es que es dinámica,
desmontándose y reconstruyéndose durante procesos celulares clave, como la
división celular. Este dinamismo contribuye a la flexibilidad y la adaptabilidad de la
célula en diferentes situaciones.
En la investigación biomédica, entender la membrana nuclear es crucial para
comprender enfermedades relacionadas con la alteración de la expresión génica.
Desentrañar cómo ésta controla el acceso al núcleo ayuda a esclarecer los
mecanismos detrás de trastornos genéticos y enfermedades como el cáncer. Por su
parte, en terapias genéticas y técnicas de ingeniería genética, la capacidad de
manipular la membrana nuclear es esencial. Introducir material genético en el núcleo
de una célula, o incluso reprogramar células para cambiar su identidad, requiere
comprender cómo interactúa la membrana nuclear con los componentes celulares.

Metafase
Metafase
Imaginemos el núcleo celular como un escenario y los cromosomas como los
protagonistas que deben colocarse meticulosamente antes de la gran actuación. La
metafase emerge como el momento culminante, el instante en que los cromosomas
alinean sus hilos en el centro del escenario, preparados para el gran acto de la
división celular.
Durante esta fase, los cromosomas, que previamente se duplicaron durante la
fase S del ciclo celular, se disponen de manera ordenada en la región central de la
célula. Es aquí donde los microtúbulos, como hábiles marionetistas invisibles, entran
en acción. Se conectan a los cinetocoros, estructuras proteicas en los cromosomas,
y comienzan a ejercer fuerzas opuestas para garantizar un equilibrio perfecto.
Las anomalías en la alineación cromosómica durante la metafase pueden
desencadenar consecuencias graves, como ser posibles causantes de trisomías o
contribuir a la inestabilidad genética característica de las células cancerosas. En el
ámbito de la reproducción asistida, la metafase también desempeña un papel
esencial. Durante la fertilización in vitro, los embriólogos deben asegurarse de que
los cromosomas de los óvulos y espermatozoides se alineen correctamente durante
la división celular, garantizando así la salud genética del embrión resultante.

Microsatelite
Microsatelite
Desde el punto de vista de la genética, los microsatélites son como gemas
codificadas en el ADN, pequeñas secuencias de nucleótidos que se repiten en
tándem. Su funcionamiento se basa en su característica principal: la variabilidad en
el número de repeticiones entre individuos de una misma especie.
¿Pero cómo se utilizan los microsatélites en el mundo científico? Su alta tasa
de mutación y su variabilidad los convierten en marcadores genéticos ideales para
estudiar la diversidad y la historia evolutiva de las especies. En biología forense, por
ejemplo, se utilizan como herramientas para la identificación de individuos en
investigaciones criminales o en pruebas de paternidad, aprovechando su capacidad
para distinguir entre personas basándose en sus perfiles genéticos únicos. En
genética de poblaciones, los microsatélites permiten trazar líneas genealógicas y
estudiar la estructura genética de las poblaciones, revelando migraciones, mezclas y
aislamientos a lo largo del tiempo.
¿Sabías que la variabilidad en la longitud de los microsatélites puede ser tan
única como una huella digital? Esta singularidad genética ha llevado a su uso en
estudios de poblaciones y genealogías. Además, los microsatélites a veces
experimentan "saltos" inusuales en su longitud, conocidos como mutaciones por
deslizamiento. Estas pequeñas "imprecisiones" en la danza genética pueden tener
consecuencias significativas, influyendo en la función génica y contribuyendo a la
variabilidad genética.

Microtubulo
Microtubulo
Imaginemos filamentos delgados, como delicados hilos de una telaraña, pero
que poseen la fuerza de los cables de acero. Estas estructuras dinámicas están
compuestas por subunidades de proteína tubulina, que se alinean para formar
cilindros largos y huecos que sirven como columna vertebral de la arquitectura
celular.
Caracterizados por su inestabilidad dinámica, los microtúbulos exhiben una
notable capacidad para crecer y encogerse de manera regulada, similar a un ballet
de flujo constante. Esta danza de crecimiento y contracción es crucial para procesos
como la división celular, donde los microtúbulos orquestan la intrincada coreografía
de la segregación cromosómica. Desempeñan innumerables funciones; por ejemplo,
actúan como rieles guía para los motores moleculares, transportando cargas vitales
como cromosomas y orgánulos a sus destinos designados dentro de la célula.
En el ámbito de la genética aplicada, los microtúbulos han encontrado
diversas aplicaciones que van desde la terapia del cáncer hasta la investigación de
enfermedades neurodegenerativas. Por ejemplo, existen fármacos que se dirigen a
los microtúbulos y se utilizan en el tratamiento de diversos tipos de cáncer al alterar
la dinámica de la división celular e inducir la apoptosis o muerte celular programada.
Además, los estudios que investigan el papel de la disfunción de estas proteínas en
enfermedades como el Alzheimer y el Parkinson han arrojado luz sobre posibles vías
terapéuticas para estas patologías.

Mitosis
Mitosis
Pensemos en la mitosis como un ballet meticulosamente coreografiado de
cinco actos: profase, prometafase, metafase, anafase y telofase. Durante estos
actos, el núcleo celular se divide, asegurando que cada célula hija reciba la
información genética necesaria para mantener la continuidad de la vida. En otras
palabras, este proceso tiene como fin generar dos células hijas portadoras de una
copia idéntica del material genético original.
En la profase, las hebras del ADN se condensan, como bailarines que se
visten para la actuación. En la metafase, los cromosomas se alinean en el centro,
listos para el gran momento. La anafase marca el acto dramático, donde las
cromátidas hermanas son separadas y tiradas hacia polos opuestos de la célula.
Finalmente, en la telofase, se forma un nuevo núcleo en cada célula hija, marcando
el fin de esta sublime danza genética.
La mitosis es esencial para el crecimiento, la reparación y la renovación
celular. En el tejido humano, por ejemplo, las células de la piel siguen este delicado
proceso para reemplazar constantemente a aquellas que se desprenden o mueren,
permitiéndonos mantener una barrera protectora firme con el paso del tiempo. En el
ámbito de la medicina, comprender la mitosis es crucial para abordar enfermedades
como el cáncer, donde el proceso de división celular puede volverse caótico. Los
tratamientos contra esta enfermedad a menudo se diseñan para interrumpir la mitosis
en células cancerosas, evitando así su propagación descontrolada.
¿Sabías que algunas células son tan rebeldes que se niegan a someterse a la
mitosis? Estas células, conocidas como células senescentes, entran en un estado de
"reposo" permanente y se resisten a dividirse, lo que puede contribuir al
envejecimiento y a diversas enfermedades relacionadas con la edad.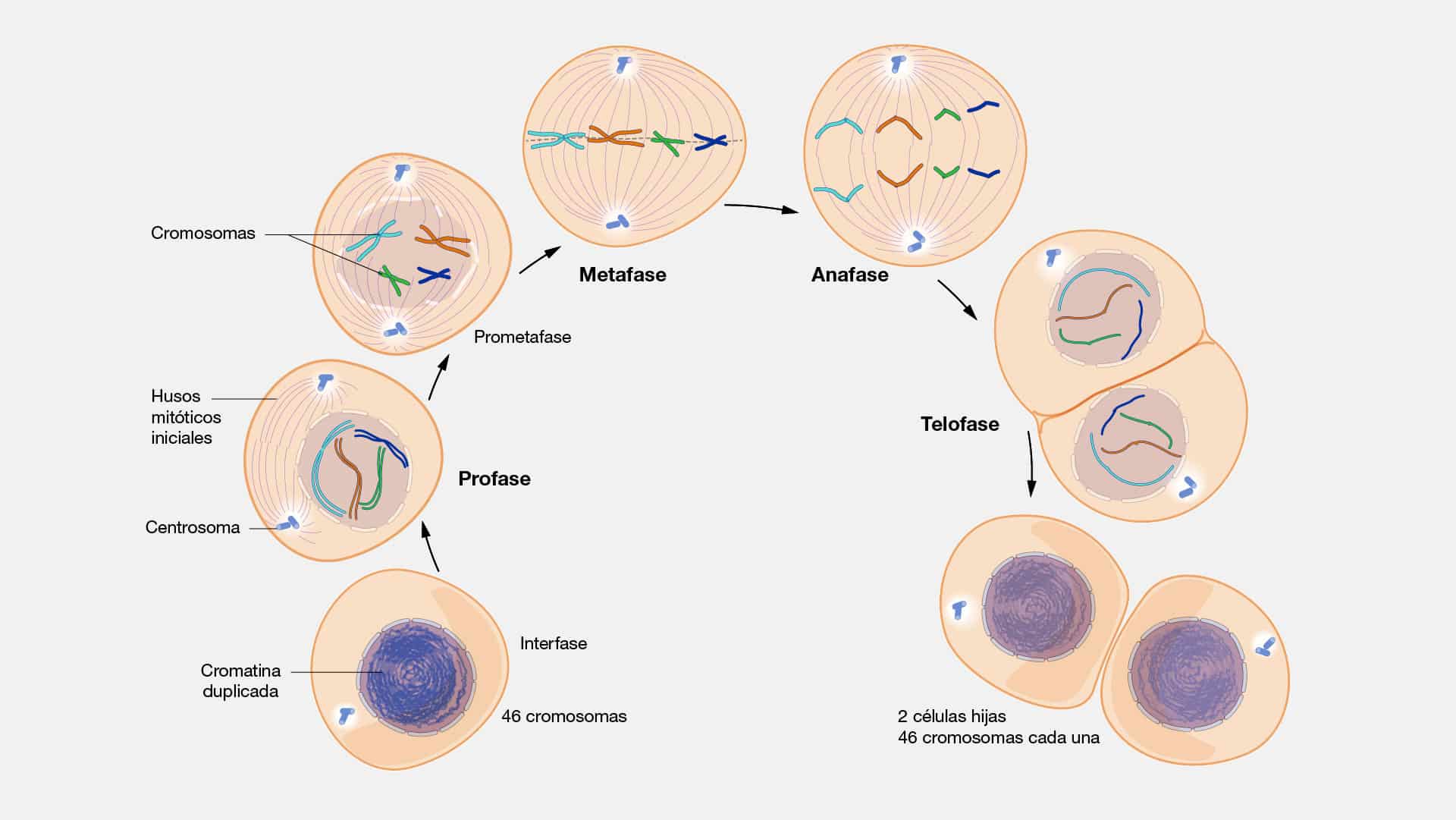

Monosomia
Monosomia
La monosomía, en el contexto genético, es una condición peculiar y
sorprendente que ocurre cuando falta un cromosoma de un par homólogo en una
célula. Esencialmente, se manifiesta cuando una célula tiene solo una copia de un
cromosoma en lugar de las dos habituales. En humanos, un ejemplo bien conocido
es el Síndrome de Turner, donde las mujeres afectadas presentan monosomía en el
par de cromosomas sexuales, siendo uno de los cromosomas X el ausente.
Esta ausencia cromosómica puede tener consecuencias significativas, ya que
la información genética contenida en ese cromosoma particular no está presente en
cantidad suficiente. Es como si una sección crucial de la partitura genética estuviera
silenciada, alterando el flujo normal de la sinfonía biológica.
En el ámbito clínico, comprender la monosomía es esencial para abordar
condiciones genéticas y sus implicaciones. Por ejemplo, puede desencadenar
procesos que contribuyen al desarrollo de ciertos tipos de cáncer.

Mutacion
Mutacion
Pensemos en el ADN como un libro de instrucciones para construir y
mantener un organismo. Las mutaciones son como errores tipográficos en ese libro.
Pueden ocurrir de diferentes maneras: puede ser que una letra se cambie por otra,
se inserte una nueva letra o se elimine una existente. Ahora, la mayoría de las veces,
estas mutaciones son neutrales, es decir, no tienen un impacto significativo. Sin
embargo, algunas pueden ser beneficiosas, ayudando a la adaptación y evolución de
una especie, mientras que otras pueden ser perjudiciales, causando enfermedades
genéticas.
Las mutaciones tienen un papel crucial en la biotecnología y la medicina. En la
agricultura, se utilizan para desarrollar cultivos más resistentes a las enfermedades o
con mejores características nutricionales. En la medicina, las investigaciones sobre
mutaciones nos permiten comprender mejor enfermedades genéticas y desarrollar
tratamientos más precisos, como la terapia génica. Por ejemplo, se ha descubierto
que ciertas mutaciones pueden ser la causa de distintos tipos de cáncer, donde un
pequeño cambio en un gen puede desencadenar un crecimiento celular
descontrolado, dando lugar a la formación de tumores.
Es fascinante ver cómo algunas mutaciones pueden ser la base de la
evolución. Por ejemplo, en la resistencia a antibióticos, que se da cuando una
bacteria muta y desarrolla resistencia a ese fármaco preciso. Esta mutación puede
transmitirse a las generaciones siguientes, creando poblaciones de bacterias
resistentes.
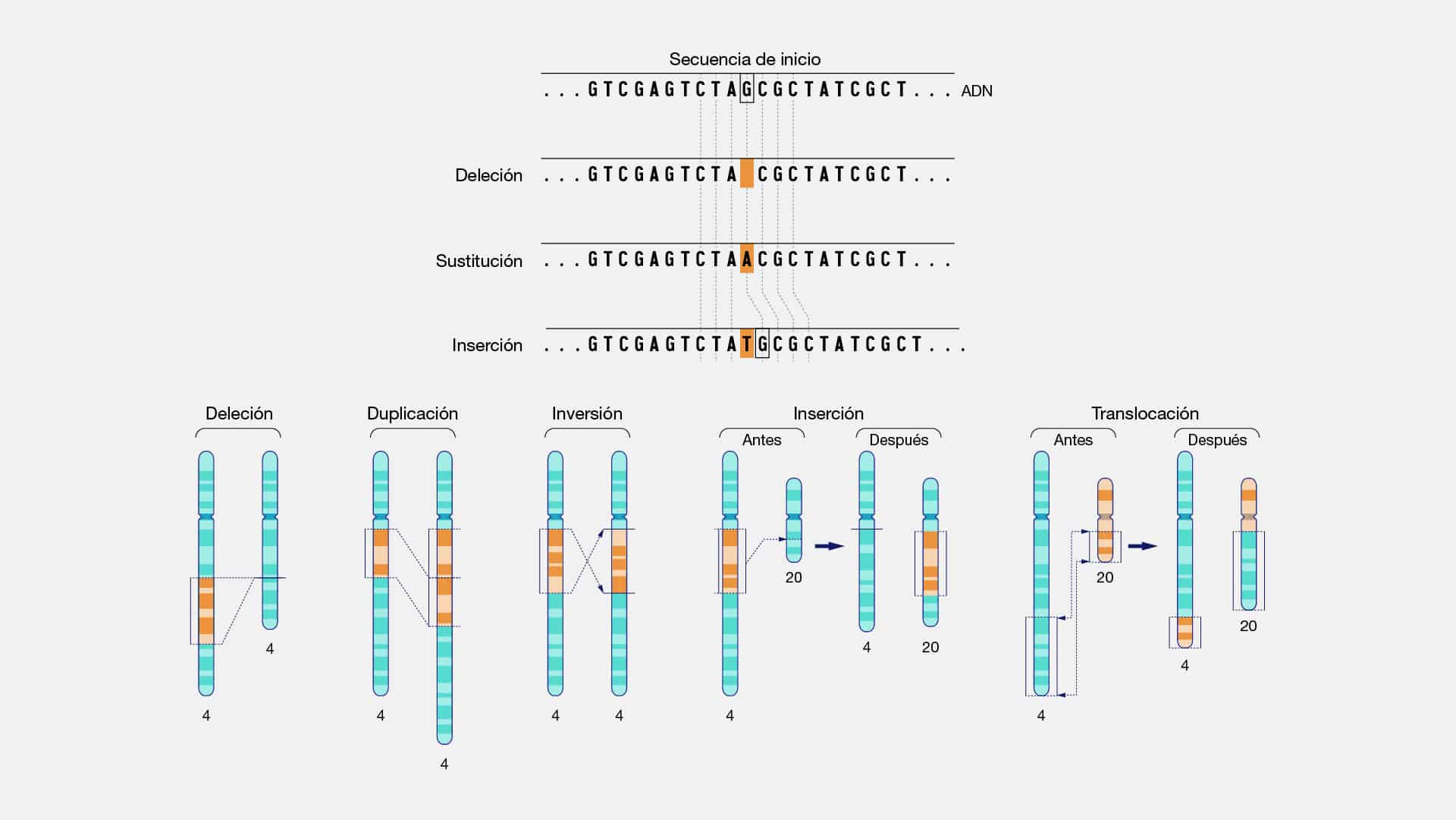

Mutacion con cambio de sentido
Mutacion con cambio de sentido
Una mutación con cambio de sentido es como un verso que se transforma en
un significado completamente diferente. Sucede cuando un solo nucleótido en el
ADN es sustituido por otro, resultando en la alteración de un aminoácido específico
en la cadena de proteínas, dado que afecta al "marco de lectura" del código genético.
Esta variación puede tener un impacto profundo en la estructura y función de la
proteína final, como si un solo cambio en la partitura modificara toda una sinfonía.
Las mutaciones con cambios de sentido pueden ser tanto héroes como
villanos en el relato de la salud humana. En algunas instancias, estas alteraciones
pueden ser benignas o incluso conferir ventajas evolutivas. En otros casos, pueden
desencadenar enfermedades genéticas devastadoras. Un ejemplo clásico es la
mutación en el gen BRCA1, asociada con un mayor riesgo de cáncer de mama y
ovario. Un cambio de sentido en este gen puede comprometer la capacidad del
cuerpo para regular el crecimiento celular, desencadenando así un drama genético
que se manifiesta en el desarrollo de ciertos tipos de cáncer.

Mutacion puntual
Mutacion puntual
En el intrincado ballet de la genética, las mutaciones puntuales son como
delicadas piruetas que alteran la coreografía de la información genética. Estos
cambios, aunque pequeños en escala, pueden tener impactos colosales en la salud y
la evolución de las especies.
Este suceso se da cuando un solo par de bases nitrogenadas (adenina,
timina, citosina, o guanina) es alterado en la secuencia del ADN. Dependiendo del
efecto que tenga este pequeño cambio, puede que no pase nada, que cause un
cambio sutil en la proteína codificada, o que tenga consecuencias más drásticas.
Un ejemplo clásico es la mutación puntual en el gen de la hemoglobina, que
da lugar a la anemia falciforme. Aquí, un solo cambio en la secuencia de ADN lleva a
la producción de una hemoglobina alterada, transformando la forma de los glóbulos
rojos y desencadenando problemas de salud significativos.
¿Sabías que estas diminutas mutaciones son la fuerza impulsora detrás de la
variabilidad genética? Algunas mutaciones puntuales pueden no tener efectos
notables, actuando como "polimorfismos silenciosos". A través de la selección
natural, estas pequeñas alteraciones pueden conferir ventajas adaptativas,
permitiendo a las especies enfrentarse a desafíos cambiantes en su entorno.

Mutacion sin cambio de sentido
Mutacion sin cambio de sentido
En el teatro de la genética, las mutaciones sin sentido son como
improvisaciones sorprendentes que cambian el significado de la obra biológica. Esta
mutación es como un malentendido en la comunicación genética. Sucede cuando un
cambio en la secuencia de ADN genera un codón de parada prematuro, como si en
medio de una oración se colocara un punto y aparte. Este codón señala el fin abrupto
de la traducción de la proteína, resultando en una versión truncada y funcionalmente
ineficaz.
Las mutaciones sin sentido son protagonistas en el drama genético de
enfermedades como la fibrosis quística. Aquí, un cambio en el ADN crea un codón de
parada prematuro, interrumpiendo la síntesis de la proteína CFTR que regula la
secreción de fluidos en las células. La consecuencia es un mal funcionamiento en las
glándulas exocrinas, manifestándose en síntomas característicos de la enfermedad.
¿Sabías que estas mutaciones a veces pueden tener efectos variables en
función de la posición en la secuencia genética donde suceden? En algunos casos,
un codón de parada prematuro puede resultar en una proteína completamente no
funcional, mientras que en otros puede tener un impacto menos drástico. Además,
estas mutaciones nos revelan una faceta intrigante de la evolución. Si bien suelen
estar asociadas con distintas enfermedades, también pueden contribuir a la
diversidad genética y, en ciertos contextos, generar cambios adaptativos.

N
No disyuncion
No disyuncion
Numerosos trastornos relacionados con el número de cromosomas se originan
a partir de un fenómeno conocido como no disyunción. Esta anomalía puede ocurrir
durante la meiosis I o la meiosis II, dependiendo de la etapa en que se presente la
incorrecta segregación cromosómica. La no disyunción meiótica ocurre cuando los
pares de cromosomas homólogos o las cromátidas hermanas no se separan
correctamente durante la división celular.
Durante la meiosis I, los cromosomas homólogos se alinean para su
separación, pero en ocasiones, la disyunción no se desarrolla según lo esperado.
Algunos cromosomas pueden quedar retenidos en el centro mientras que otros se
desplazan hacia los extremos, generando así incertidumbre y añadiendo un toque de
misterio a la danza genética. En la meiosis II, los cromosomas vuelven a dividirse,
aumentando la diversidad genética.
Los errores durante la meiosis I pueden originar células sexuales con
combinaciones cromosómicas incorrectas, lo que conlleva a condiciones genéticas
anómalas o a la formación de gametos con un número anormal de cromosomas.
El estudio de la no disyunción no solo nos ayuda a comprender mejor las
condiciones genéticas, sino que también, proporciona herramientas para diagnosticar
y tratar enfermedades. Por ejemplo, en medicina reproductiva, el análisis de la no
disyunción en embriones puede ayudar a seleccionar aquellos con menor riesgo de
anomalías cromosómicas, mejorando así las tasas de éxito en técnicas de
reproducción asistida como la fecundación in vitro.

Northern blot
Northern blot
En el inmenso escenario de las técnicas genéticas, el Northern Blot destaca
por su capacidad para identificar y separar los ARN que participan en la sinfonía
molecular de la vida. Esta técnica utiliza una danza especial de geles y sondas de
ADN marcadas, permitiendo que los fragmentos de ARN revelen su presencia de
manera precisa.
Esta técnica poderosa que nos permite estudiar los niveles de expresión
génica y la estructura de los ARN en una muestra, se desarrolla en cinco pasos:
comenzando con la extracción del ARN, su fraccionamiento por medio de
electroforesis en gel y la posterior transferencia a una membrana de nitrocelulosa o
nylon. A la fijación e hibridación, donde la membrana se incuba con una sonda de
ADN o ARN complementaria marcada con un isótopo radiactivo o una etiqueta
fluorescente, le sigue la detección de la sonda, lo que permite visualizar y cuantificar
el ARN de interés de la muestra.
El Northern Blot tiene una amplia gama de aplicaciones en investigación
biomédica y biotecnología. Por ejemplo, se utiliza para estudiar la expresión génica
en diferentes condiciones fisiológicas o patológicas, identificar ARN específicos
asociados con enfermedades, validar datos de expresión génica obtenidos por
técnicas de alto rendimiento, y caracterizar la estructura y la función de ARN no
codificantes.

Nucleo celular
Nucleo celular
El núcleo celular es el epicentro de la actividad genética en las células eucariotas, donde residen y se regulan los genes. Es como el director de orquesta de una célula, coordinando todas las actividades que allí ocurren. En el núcleo encontramos tres componentes principales: la cromatina, la membrana nuclear y el nucléolo.
La cromatina es una red de ADN, proteínas y ARN que forman los
cromosomas durante la división celular. Este material genético almacena toda la
información necesaria para el desarrollo y funcionamiento de un organismo. Por su
parte, la membrana nuclear rodea el núcleo y separa su contenido del citoplasma.
Está perforada por poros nucleares que regulan el paso de moléculas, permitiendo el
intercambio de ARN, proteínas y otras biomoléculas necesarias para la función
celular. La última pieza clave que compone al núcleo celular es el nucléolo, que se
define como la región especializada del núcleo donde se sintetizan los ribosomas.
El estudio del núcleo celular y sus componentes es fundamental en el campo
de la biología celular y molecular. Entender cómo se regula la expresión génica en el
núcleo es crucial para comprender enfermedades genéticas, desarrollar terapias
génicas y diseñar fármacos.
Un dato muy curioso es que si el ADN humano se desenrollara y estirara,
podría llegar a medir aproximadamente dos metros de longitud, aunque cabe dentro
del diminuto núcleo celular gracias a su empaquetamiento en la cromatina.


Nucleolo
Nucleolo
Aunque pueda pasar desapercibido en el escenario del núcleo, el nucleolo es
un compositor incansable de la célula. Se encuentra dentro del núcleo celular y está
compuesto principalmente de ARN ribosómico y proteínas. Su función principal es la
síntesis y ensamblaje de los componentes estructurales de los ribosomas, las
fábricas de proteínas de la célula.
El nucleolo no solo es el taller de ensamblaje de los ribosomas, sino que
también influye en la velocidad y la eficiencia de la síntesis proteica. Cuando las
células requieren más proteínas, el nucleolo responde aumentando su actividad. Este
proceso es esencial para funciones celulares fundamentales, como el crecimiento y
la reparación.
¿Sabías que el nucleolo no es estático, sino dinámico? Durante la división
celular, cuando el núcleo se divide, el nucleolo desaparece temporalmente, solo para
resurgir en las células hijas.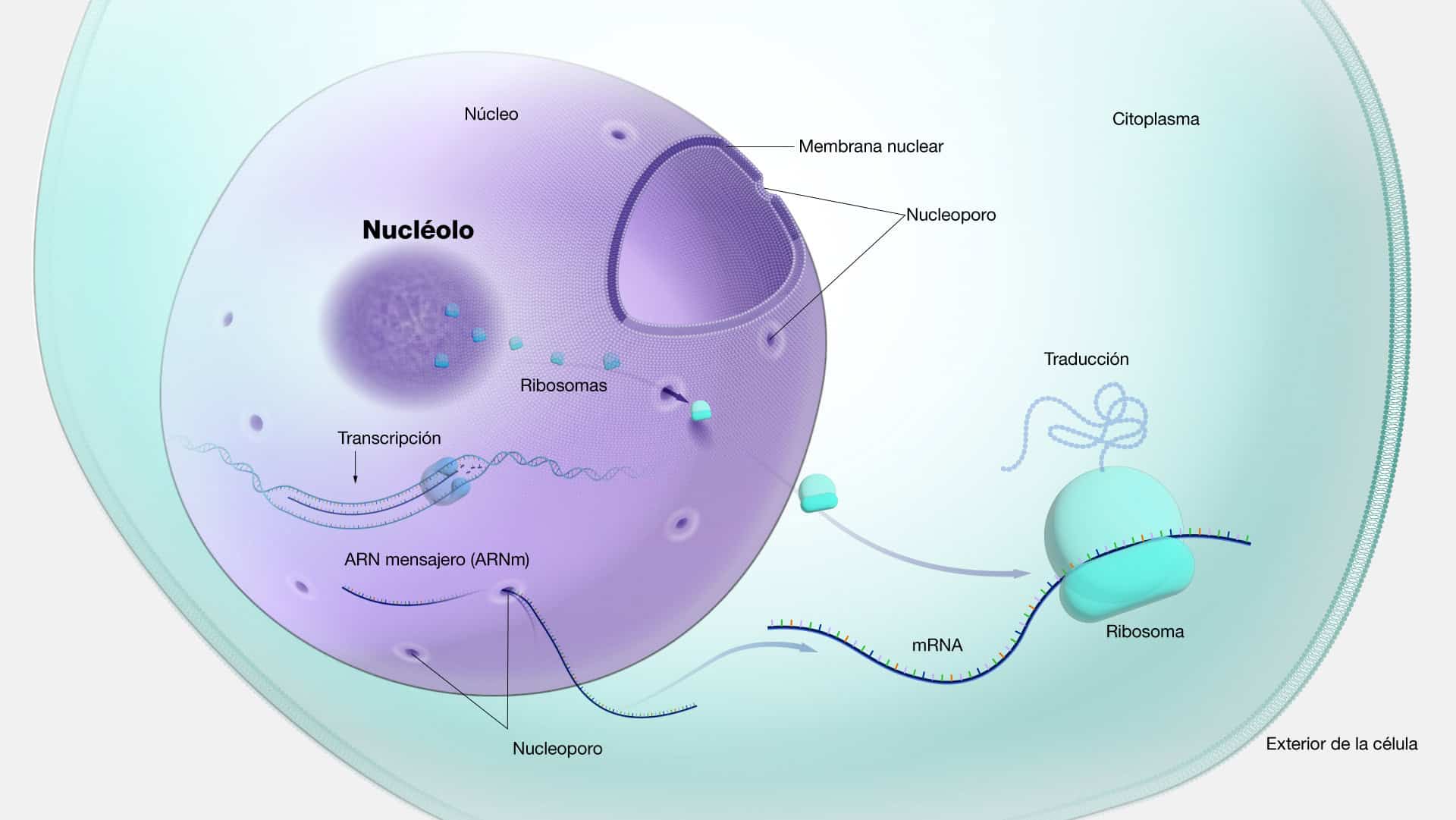

Nucleotido
Nucleotido
Pensemos en los nucleótidos como los bloques de construcción que
componen la partitura genética, tanto en el ADN como en el ARN. Son las letras en el
libro de la vida, las piezas clave que conforman nuestro código genético.
Un nucleótido es una estructura elegante y compleja compuesta por tres
elementos fundamentales: una base nitrogenada, como la adenina (A), timina (T),
citosina (C) y guanina (G) en el ADN, y uracilo (U) en el ARN. También está
conformado por un azúcar como desoxirribosa en el ADN y ribosa en el ARN. Por
último, un grupo fosfato completa este trío, proporcionando la estructura y la energía
necesarias para la replicación y la transcripción genética. La combinación de estas
bases nitrogenadas en el ADN y el ARN sigue reglas estrictas, lo que garantiza la
precisión en la transmisión de la información genética.
Su estudio minucioso no solo nos permite desentrañar los misterios del ADN y
ARN, los archivos codificados de la vida, sino que también, abre las puertas a un
sinfín de aplicaciones prácticas. En medicina, los nucleótidos son aliados
imprescindibles en la lucha contra enfermedades genéticas, que permiten detectar
mutaciones, diagnosticar trastornos hereditarios y diseñar terapias génicas
innovadoras. Por otro lado, en la industria, los nucleótidos son la materia prima de la
biotecnología, impulsando avances en la producción de medicamentos,
biocombustibles y productos químicos de alto valor agregado. Su versatilidad y
capacidad para ser manipulados nos abren un abanico de posibilidades para
desarrollar tecnologías más limpias y eficientes.
¿Sabías que la secuencia específica de nucleótidos en el ADN es lo que
determina nuestra información genética única? Es como tener un código de barras
molecular que distingue a cada individuo.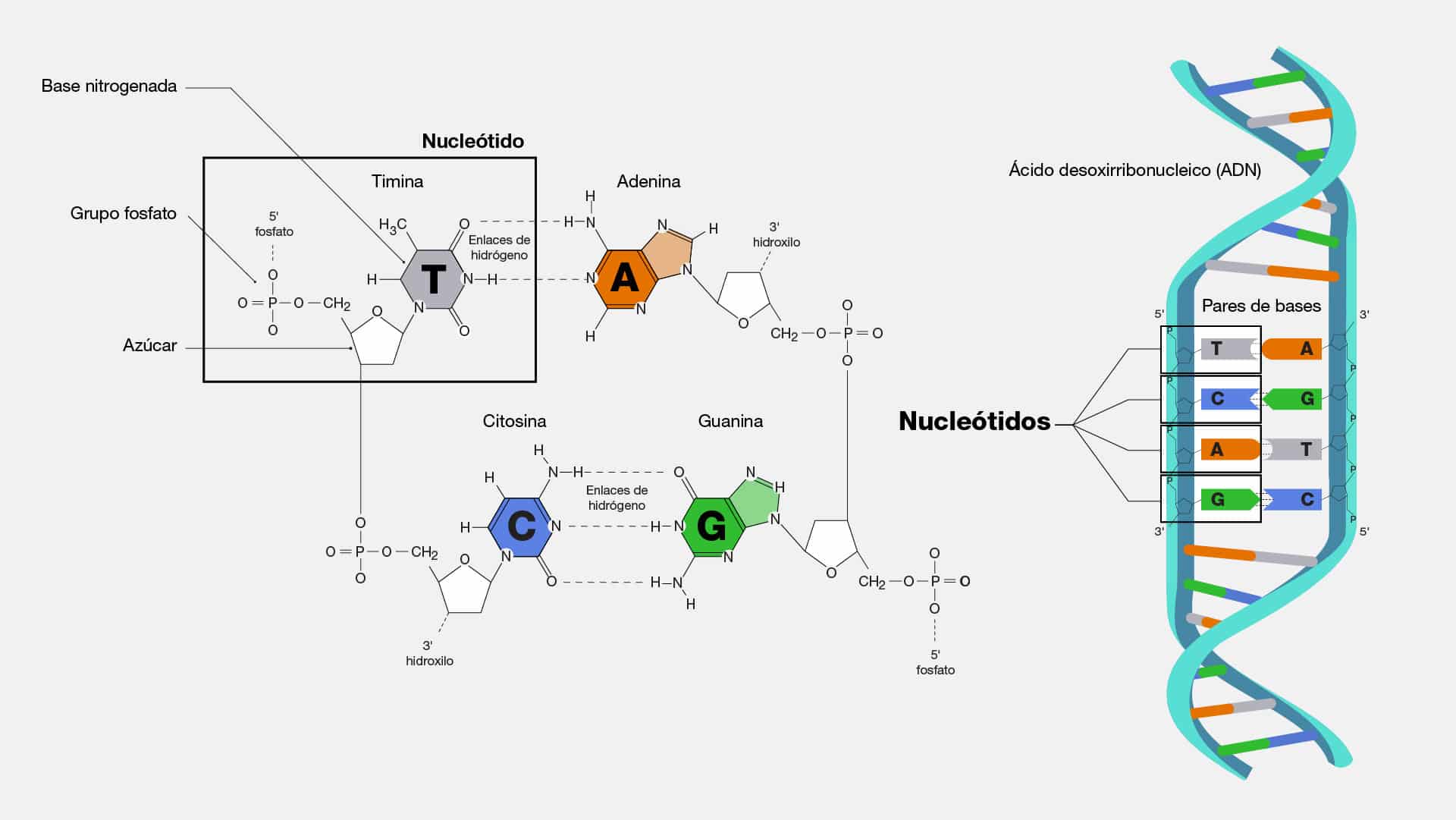

Nuclosoma
Nuclosoma
Imaginemos al nucleosoma como el arquitecto maestro que transforma el ADN
en una estructura compacta y ordenada, permitiendo que la célula organice su
información genética de manera eficiente.
El nucleosoma es como un delicado collar de perlas que adorna la hebra de
ADN. Está compuesto por histonas, proteínas especializadas que actúan como las
joyas en este collar molecular. El ADN se enrolla alrededor de este conjunto de
histonas, formando una estructura en forma de esfera que representa el primer nivel
de organización de la cromatina.
Cabe destacar que, no solo es un componente pasivo, sino que también está
vinculado a procesos fundamentales como la reparación y el acceso al ADN o la
regulación de la actividad génica. Cuando la célula necesita acceder a ciertos
segmentos de información genética, el nucleosoma actúa como una especie de
librero que organiza y presenta los capítulos relevantes para su lectura.
En medicina, el conocimiento detallado de la estructura y función del
nucleosoma es fundamental para comprender diversas enfermedades. Por ejemplo,
se ha descubierto que alteraciones en la organización de la cromatina, mediada por
los nucleosomas, están estrechamente relacionadas con el desarrollo de cáncer. La
capacidad de los nucleosomas para regular la expresión génica y controlar la
replicación del ADN es crucial en la aparición y progresión de tumores. Entender
cómo se modifica la estructura de la cromatina y cómo afecta a la actividad génica
puede proporcionar valiosas pistas para el diagnóstico y tratamiento del cáncer. Por
otro lado, en el campo de la epigenética, su estudio brinda una perspectiva única
sobre cómo los factores ambientales pueden influir en la expresión génica sin
cambiar la secuencia del ADN. Se ha demostrado que las modificaciones
post-transcripcionales de los nucleosomas, pueden heredarse de una generación a
otra y desempeñar un papel crucial en la regulación de la actividad génica durante el
desarrollo embrionario.

O
Oncogen
Oncogen
Los oncogenes son las variantes modificadas de los protooncogenes, que son
genes normales que se encargan de regular procesos celulares vitales como el
crecimiento y la diferenciación. Cuando un protooncogén sufre una mutación, se
convierte en un oncogén, ganando la capacidad de impulsar el crecimiento celular sin
restricciones.
El papel de los oncogenes en el cáncer es multifacético: estos genes alterados
pueden desencadenar el crecimiento celular descontrolado y eludir los mecanismos
de regulación celular. El descubrimiento y la comprensión de estos genes han
transformado la oncología, permitiendo el desarrollo de terapias dirigidas que se
centran en estas moléculas desreguladas específicamente, sin causar daño
significativo a las células sanas.

P
Pares de base
Pares de base
Los pares de bases son los cimientos mismos de la herencia biológica. En el
baile genético, hay dos tipos de parejas: adenina (A) emparejada con timina (T), y
guanina (G) entrelazada con citosina (C). La regla es clara: A siempre baila con T, y
G se enlaza invariablemente con C. Esta armonía de pares de bases forma los
escalones de la famosa escalera en espiral del ADN. Esta fidelidad molecular es la
clave de la estabilidad y la replicación del ADN, garantizando que la información
genética se transmita fielmente de una generación a otra. Cuando una célula se
divide, cada cadena de ADN se replica y se separa, y gracias a la precisión en la
formación de los pares de bases, se generan dos copias idénticas.
La danza de las bases no solo ocurre en el ámbito biológico, sino que ha
inspirado avances tecnológicos asombrosos. La técnica de secuenciación de ADN,
por ejemplo, utiliza la complementariedad de las bases para leer y decodificar la
información genética. En la medicina, comprender estos pares de bases es esencial
para el diagnóstico y tratamiento de enfermedades hereditarias.

Pariente de primer grado
Pariente de primer grado
Los parientes de primer grado comparten la mitad de su material genético, lo
que significa que comparten aproximadamente el 50% de sus genes. Esto incluye
relaciones como padres, hijos y hermanos. En esta cercanía genética, la información
hereditaria fluye de una generación a otra, tejiendo patrones únicos que nos
conectan de manera innegable.
Comprender la genética de nuestros familiares cercanos no solo nos brinda
fascinantes visiones de nuestra historia familiar, sino que también, tiene importantes
aplicaciones en campos como la medicina. Por ejemplo, en la identificación y manejo
de enfermedades genéticas, los datos sobre nuestros parientes de primer grado
pueden resultar fundamentales. Además, la compatibilidad genética adquiere una
relevancia vital en procedimientos médicos como los trasplantes de órganos y otros
tratamientos relacionados.
Los gemelos idénticos, también conocidos como gemelos monocigóticos, son
un ejemplo excepcional de parientes de primer grado. Comparten el 100% de sus
genes, en lugar del 50% como otros hermanos, lo que los convierte en un caso de
fascinante similitud genética.

PCR
PCR
Pensemos en una pequeña máquina capaz de copiar una única página de un
extenso libro, una y otra vez, hasta tener miles de copias idénticas. La reacción en
cadena de la polimerasa (PCR, por sus siglas en inglés) es esa máquina maravillosa.
Utilizando una pequeña cantidad de ADN como molde, la PCR amplifica
selectivamente la región de interés, generando una abundancia de copias para su
posterior análisis.
Esta técnica se basa en la actividad de la enzima ADN polimerasa, que,
guiada por cebadores diseñados específicamente, sintetiza nuevas cadenas de ADN
complementarias a la región que queremos estudiar. El ciclo se repite varias veces,
aumentando exponencialmente la cantidad de ADN deseado.
La PCR ha dejado una huella indeleble en numerosos campos. En la
medicina, es utilizada para diagnosticar enfermedades hereditarias, identificar
patógenos, y en el análisis forense para comparar perfiles genéticos. En el campo de
la investigación científica, es esencial para la clonación de genes, la secuenciación
de ADN, y la creación de bibliotecas genómicas. También se ha convertido en una
herramienta clave en la biotecnología, permitiendo la producción masiva de
secuencias genéticas específicas.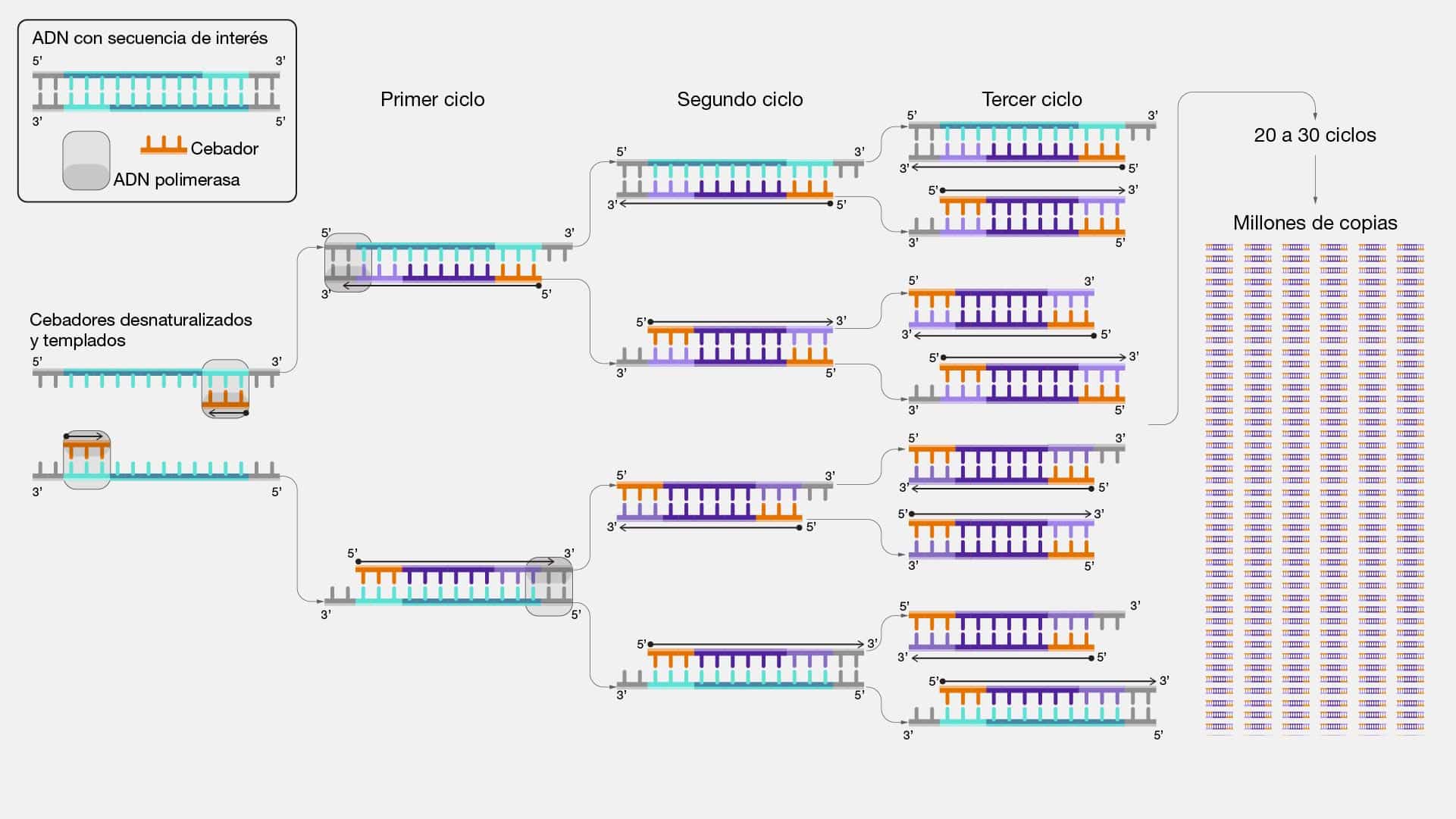

Pedigri (genealogia)
Pedigri (genealogia)
Imaginemos una intrincada red de hilos que conectan una generación tras
otra, revelando los secretos de nuestra herencia genética. Eso es el pedigrí, un mapa
genealógico que plasma de manera gráfica la ascendencia y descendencia de
individuos, destacando características genéticas y posibles patrones hereditarios.
El pedigrí, también conocido como árbol genealógico genético, presenta una
serie de símbolos y líneas que dan vida a la historia biológica de una familia. Cada
símbolo representa a un individuo, con líneas que conectan padres e hijos, revelando
la transmisión de genes a lo largo de las generaciones. Los círculos representan a
las mujeres, los cuadrados a los hombres, y las líneas horizontales conectan a
parejas, dando forma a un relato visual que desentraña la complejidad de la
herencia.
Es un aliado invaluable en la genética médica, permitiendo identificar patrones
hereditarios de enfermedades genéticas, facilitando así la predicción de riesgos y el
correcto asesoramiento genético. En el campo de la cría selectiva, el pedigrí es
esencial para trazar líneas de sangre en animales y plantas, optimizando las
características deseadas. En investigaciones sobre la genética de poblaciones, se
transforma en una herramienta crucial para comprender la variabilidad génica y
rastrear la propagación de ciertos alelos a lo largo del tiempo.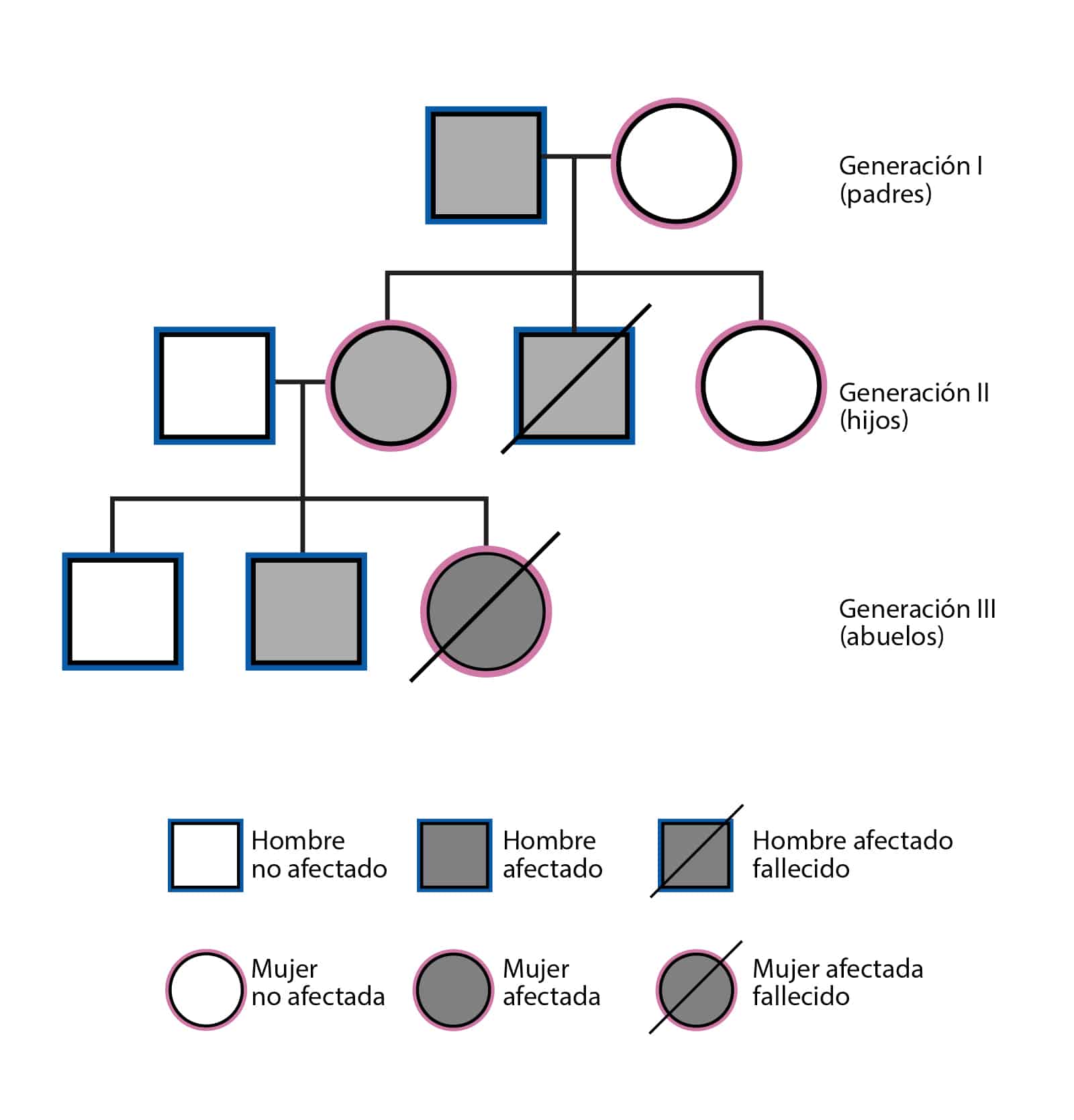

Peptido
Peptido
Los péptidos son cadenas cortas de aminoácidos, los ladrillos fundamentales
de las proteínas. Su estructura modular les confiere la capacidad de formar enlaces
específicos, creando una variedad infinita de combinaciones que determinan la
función de la proteína resultante. Estas cadenas peptídicas pueden ser tan diminutas
como dos aminoácidos, o extenderse hasta unas pocas decenas. Su versatilidad les
permite actuar como mensajeros, transportadores, enzimas y reguladores,
desempeñando roles cruciales en la orquesta molecular de la vida.
La versatilidad de los péptidos se manifiesta en una variedad de aplicaciones,
desde la industria farmacéutica hasta la cosmética y la investigación médica. En
medicina, algunos se han convertido en héroes terapéuticos, como las insulinas
sintéticas utilizadas para tratar la diabetes. Los péptidos antimicrobianos, por otro
lado, son los defensores naturales del sistema inmunológico, luchando contra
bacterias y patógenos invasores. En cuanto a la cosmética, péptidos como el
colágeno, han conquistado el mundo anti-envejecimiento al contribuir a la elasticidad
y firmeza de la piel.
Algunos péptidos tienen propiedades bioactivas sorprendentes. Por ejemplo,
la famosa endorfina, conocida como la "hormona de la felicidad"; es un péptido que
actúa como neurotransmisor, ayudándonos a sentirnos bien y aliviar el dolor.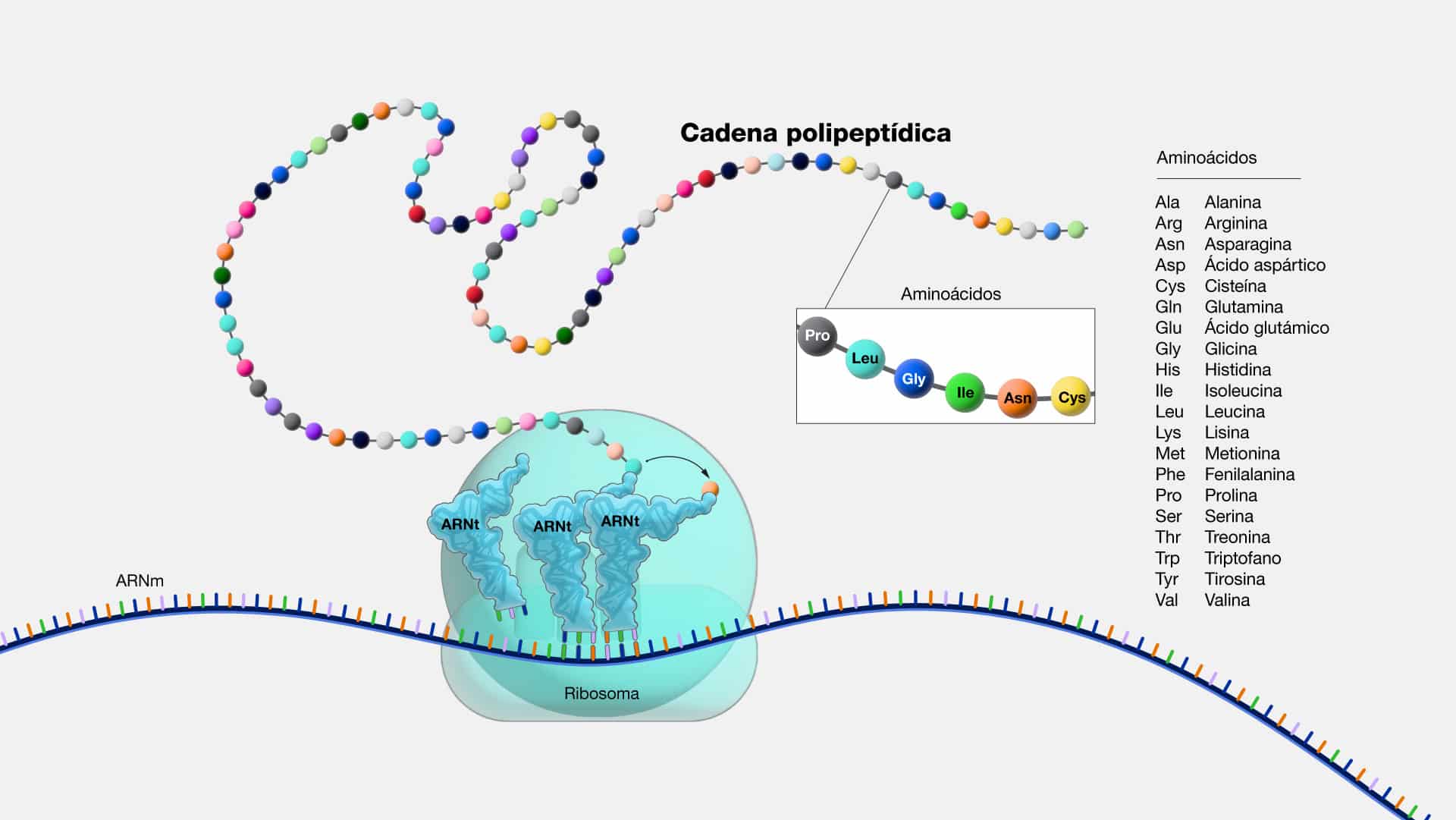

Plasmido
Plasmido
Los plásmidos son pequeñas moléculas circulares de ADN que se encuentran
en bacterias y en algunos otros organismos unicelulares. Aunque no son parte del
cromosoma bacteriano principal, constituyen elementos genéticos importantes
debido a su aptitud para replicarse de forma independiente dentro de la célula
hospedadora, gracias a que poseen un promotor y un origen de replicación. Esto
significa que pueden multiplicarse rápidamente y, en algunos casos, transferirse entre
diferentes organismos. Esta característica no solo confiere versatilidad genética sino
también la capacidad de propagar información beneficiosa de una célula a otra.
Los plásmidos han encontrado su lugar en el escenario de la ingeniería
genética, siendo herramientas valiosas en la manipulación y transferencia de genes.
En la fabricación de organismos genéticamente modificados (OGM), los plásmidos se
utilizan como vectores, transportando genes deseados de una especie a otra. Para
ello, se les incluye un marcador de selección, que facilita la identificación de las
células que han tomado el plásmido; y por supuesto, el gen de interés, que puede ser
cualquier secuencia de ADN que se desee expresar. En bacterias, actúan como
portadores de resistencia a antibióticos. Este fenómeno, conocido como transferencia
horizontal de genes, permite que las bacterias adquieran velozmente resistencia a
los antibióticos mediante la obtención de plásmidos de otras bacterias.
¿Sabías que algunos plásmidos tienen sistemas de defensa propios? Se trata
de sistemas de restricción-modificación, que actúan como guardianes moleculares
para proteger el contenido genético del plásmido contra la invasión de ADN extraño.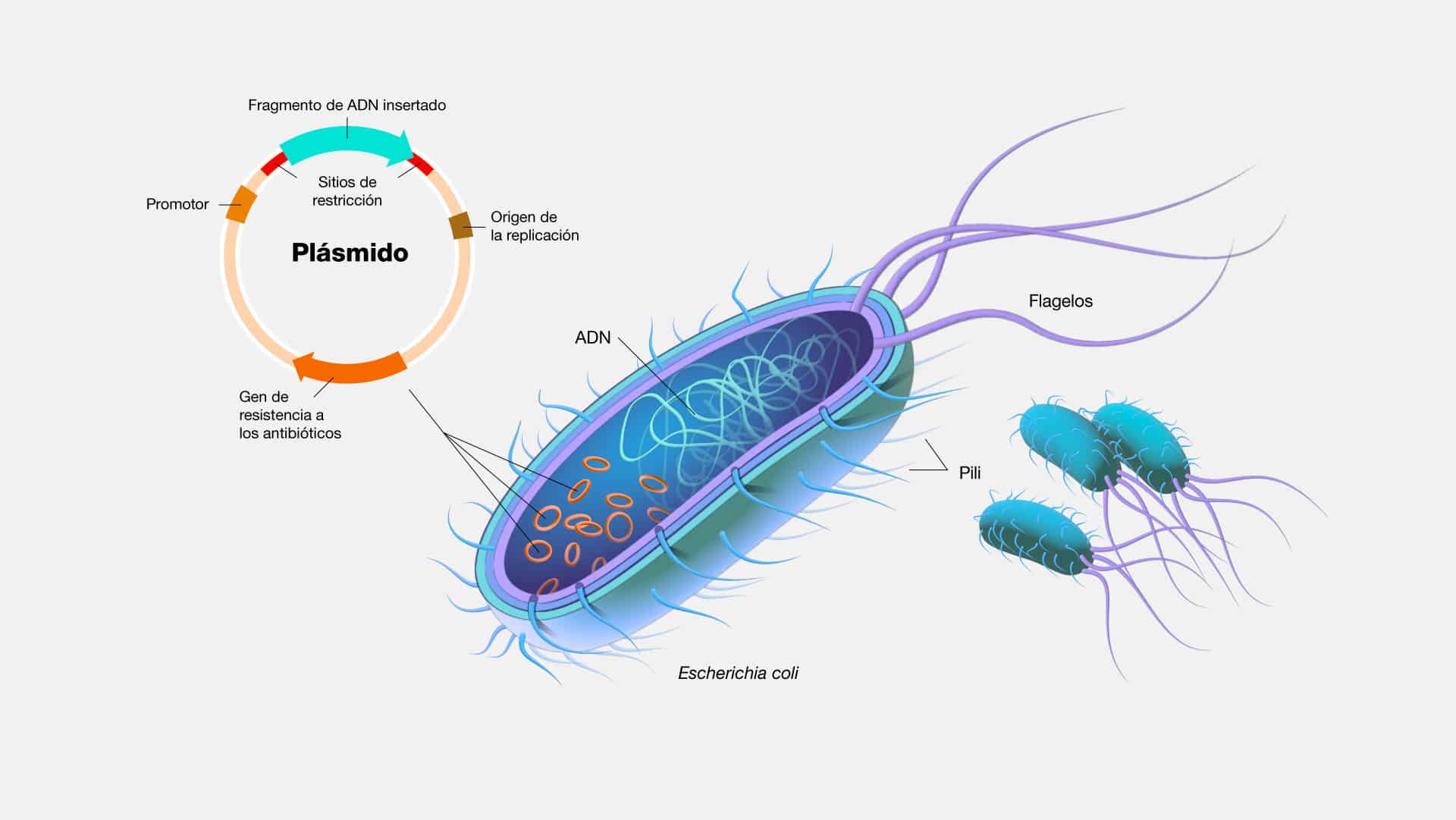

Polimorfismo
Polimorfismo
En términos simples, el polimorfismo se refiere a la existencia de múltiples
formas o variaciones genéticas dentro de una población, causadas por mutaciones
en el ADN. Este fenómeno es crucial en genética y biología evolutiva, ya que
representa la diversidad génica que encontramos en la naturaleza.
El polimorfismo es la base de la diversidad genética que permite a las
especies adaptarse a entornos cambiantes y evolucionar a lo largo del tiempo.
Además de ser ampliamente utilizado en genética de poblaciones y evolutiva,
también tiene aplicaciones prácticas en campos como la medicina y la agricultura. En
medicina, el estudio de variantes genéticas puede ayudar a comprender la
predisposición génica a enfermedades y a personalizar tratamientos médicos. En
cuanto a la agricultura, el estudio de polimorfismos es crucial para la mejora genética
de cultivos y ganados, permitiendo desarrollar variedades resistentes a
enfermedades y condiciones ambientales adversas.

Poro nuclear
Poro nuclear
El núcleo celular es el centro de control donde reside el ADN, la esencia
misma de la vida. Los poros nucleares son los porteros de esta fortaleza, estructuras
complejas y sofisticadas incrustadas en la envoltura nuclear, que permiten el tráfico
controlado de moléculas esenciales para la vida, como los ARN mensajeros y
diversas proteínas.
Su arquitectura exquisitamente selectiva y dinámica, permite la regulación con
precisión milimétrica del flujo de moléculas. En otras palabras, actúan como filtros
que aprueban el paso solo a aquellas sustancias que poseen las credenciales
adecuadas, gracias a complejos mecanismos de reconocimiento celular.
La investigación en biotecnología y medicina ha encontrado en los poros
nucleares un campo fértil para el desarrollo de terapias innovadoras. La comprensión
de su funcionamiento ha permitido diseñar sistemas de entrega de fármacos dirigidos
específicamente al núcleo celular, abriendo nuevas vías para el tratamiento de
enfermedades como el cáncer y otros trastornos genéticos.
¿Sabías que estos portales no son estáticos, sino dinámicos? Se remodelan
constantemente para adaptarse a las necesidades cambiantes de la célula,
expandiéndose o contrayéndose según la demanda del momento.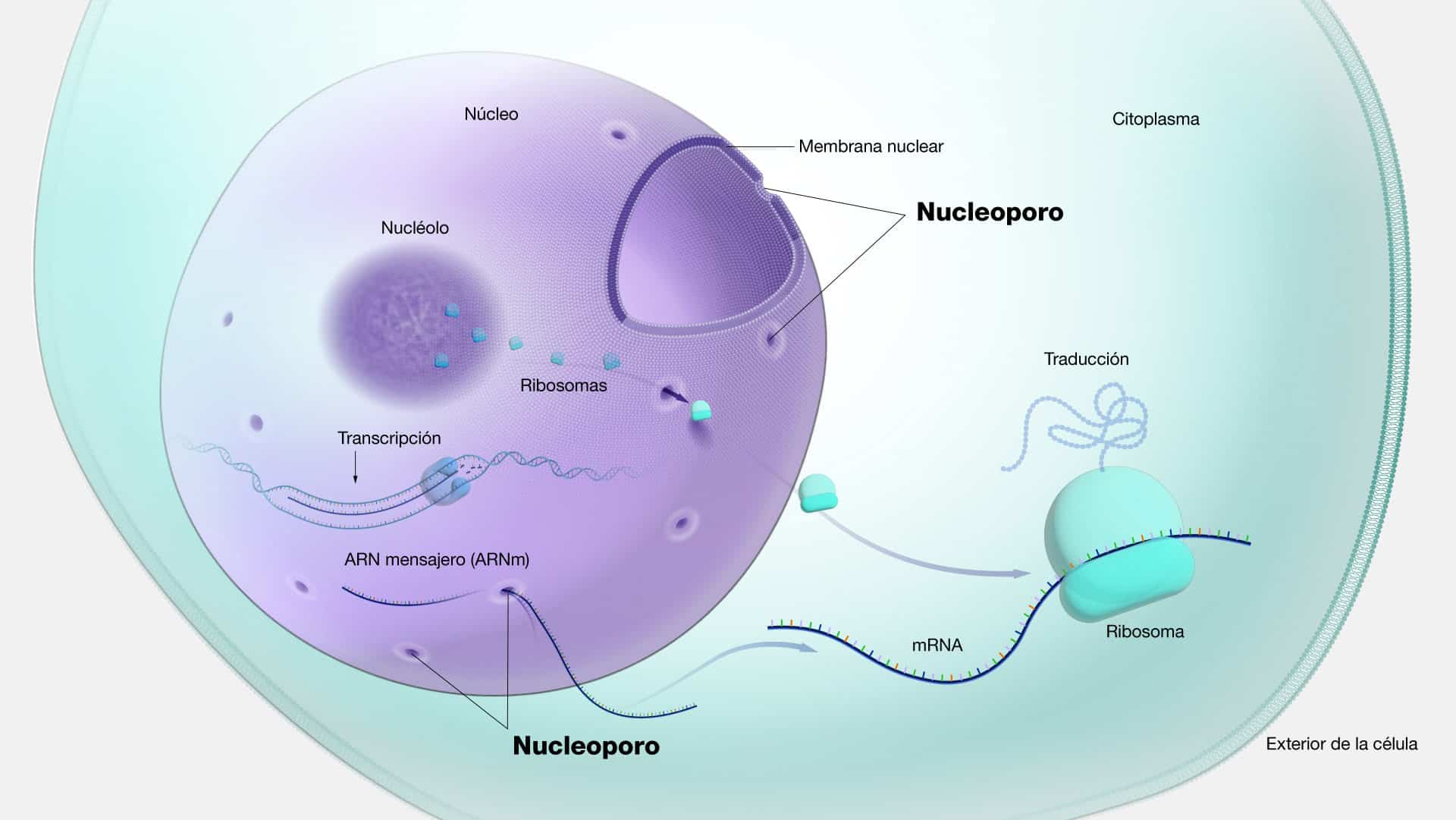

Portador
Portador
En el corazón de la genética, el portador es aquel individuo que alberga una
versión de un gen específico sin expresar necesariamente las características
asociadas a ese gen. Este concepto es clave en el mundo de las enfermedades
genéticas, donde ciertos genes pueden ser portados de generación en generación
sin manifestarse clínicamente.
El portador, en su esencia biológica, puede parecer invisible en términos de
síntomas, pero su importancia radica en la transmisión potencial de información
genética a la descendencia. Este fenómeno es particularmente destacado en
condiciones recesivas, donde se requieren dos copias del gen alterado, es decir, que
estén en homocigosis, para que se manifieste la enfermedad.
Los portadores desempeñan un papel crucial en la predicción y prevención de
enfermedades hereditarias. Por ejemplo, en parejas donde ambos son portadores de
un gen recesivo para cierta enfermedad, existe el riesgo de que sus descendientes
hereden ambas copias alteradas y la manifiesten clínicamente. El consejo genético y
las pruebas prenatales son herramientas que permiten a las parejas tomar
decisiones informadas sobre la planificación familiar y la gestión del riesgo genético.

Promotor
Promotor
En el escenario de la biología molecular, el promotor es una región del ADN
ubicada al inicio de un gen. Su presencia es fundamental para garantizar que la
información genética se traduzca a proteínas, los actores protagónicos en el teatro
celular.
Una de sus funciones principales es proporcionar el sitio de inicio para la
transcripción, el proceso mediante el cual el ADN se transcribe a ARNm. Además, el
promotor contiene secuencias específicas, llamadas cajas TATA y cajas iniciadoras,
que actúan como señales para reclutar la maquinaria molecular necesaria para iniciar
la síntesis de ARN.
El promotor juega un papel fundamental en la regulación de la expresión
génica, es decir, cómo y cuándo se activa un gen para producir proteínas. Por
ejemplo, en la respuesta del sistema inmunológico a una infección, los promotores de
los genes relacionados con la defensa del organismo se activan, permitiendo una
respuesta rápida y coordinada.
A veces, pequeñas variaciones en las secuencias de promotores pueden tener
grandes efectos en la expresión génica y estar asociadas con condiciones médicas o
variaciones individuales en la respuesta a fármacos. Una enfermedad que puede ser
causada por una alteración en un promotor génico es la talasemia, un trastorno
sanguíneo hereditario en el cual el cuerpo produce una cantidad anormal de
hemoglobina. En algunos casos, esta enfermedad puede ser causada por
mutaciones en los promotores genéticos que controlan la producción de las cadenas
de globina (subunidades de la hemoglobina). Estas alteraciones pueden interferir con
la capacidad del organismo para producir cantidades adecuadas de hemoglobina, lo
que resulta en anemia y otros problemas de salud asociados con la talasemia.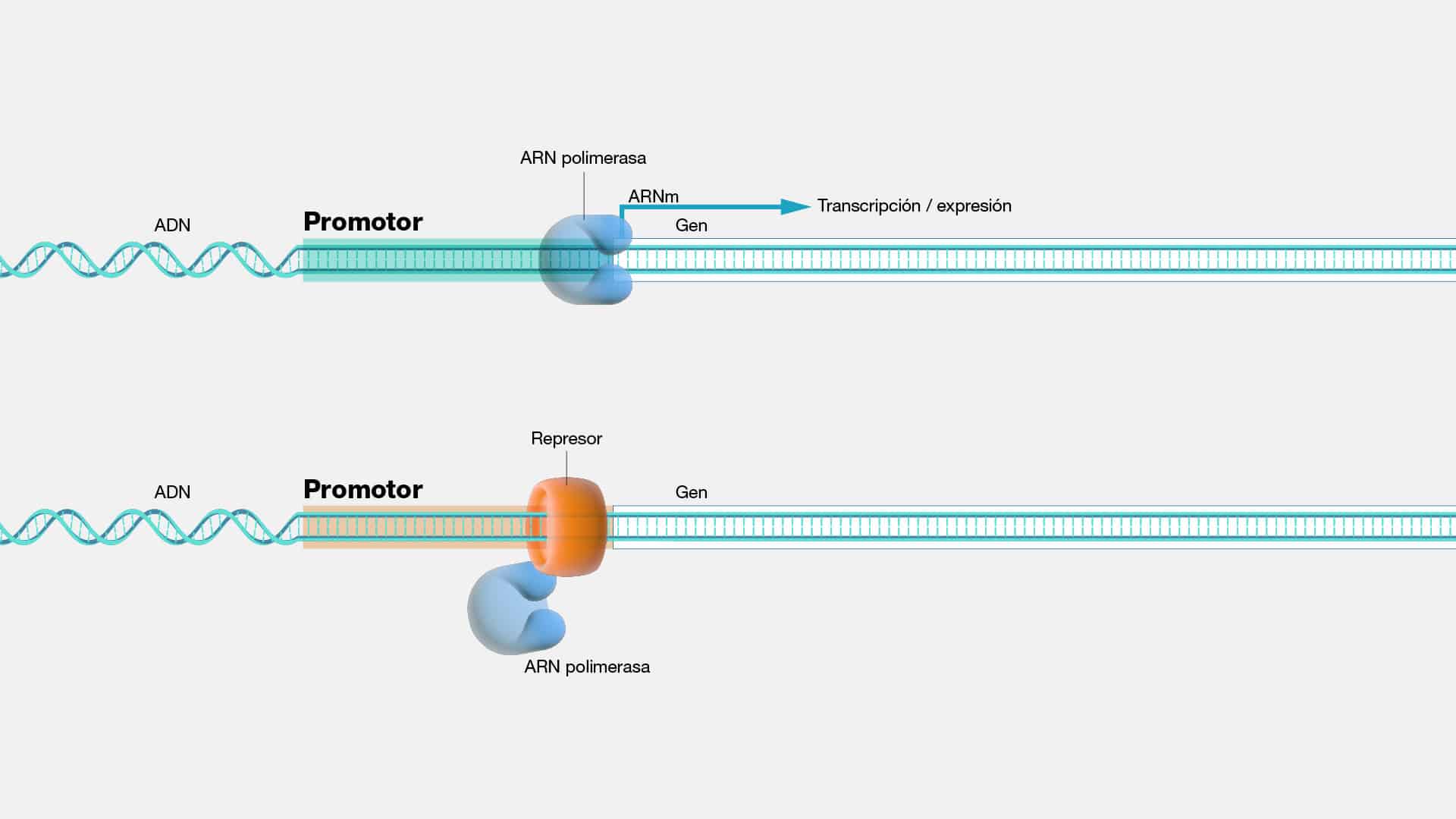

Proteina
Proteina
En el corazón de cada célula, las proteínas son las protagonistas indiscutibles.
Estas moléculas son como bailarinas meticulosamente ensayadas, ejecutando
movimientos definidos y desempeñando funciones cruciales en cada acto del drama
biológico. Las proteínas son macromoléculas compuestas por cadenas lineales de
aminoácidos, plegadas en formas tridimensionales específicas que determinan su
estructura y función.
Existe un amplio espectro de funciones que estas moléculas pueden realizar.
Por mencionar algunos ejemplos, destacamos las enzimas, encargadas de catalizar
reacciones bioquímicas; los anticuerpos, que protegen al organismo contra
invasores; y aquellas que actúan como transportadoras, moviendo moléculas a
través de las membranas celulares. También pueden llevar a cabo funciones
hormonales, actuando como mensajeros químicos que regulan procesos corporales
como el crecimiento y el metabolismo. Además, no podemos olvidar el papel
fundamental que desempeñan en la estructura y función celular, así como su
importancia crucial en la comunicación entre células.
En el escenario celular, las proteínas despliegan su talento en una variedad de
funciones, mientras que en el ámbito de la tecnología, se utilizan en un sin fin de
aplicaciones fascinantes. Por ejemplo, en la industria alimentaria, las enzimas
proteicas se utilizan para mejorar la textura y el sabor de los alimentos, así como
también, para prolongar su vida útil. En medicina, las proteínas recombinantes,
obtenidas mediante técnicas de ingeniería genética, se emplean en terapias para
tratar enfermedades como la diabetes y el cáncer.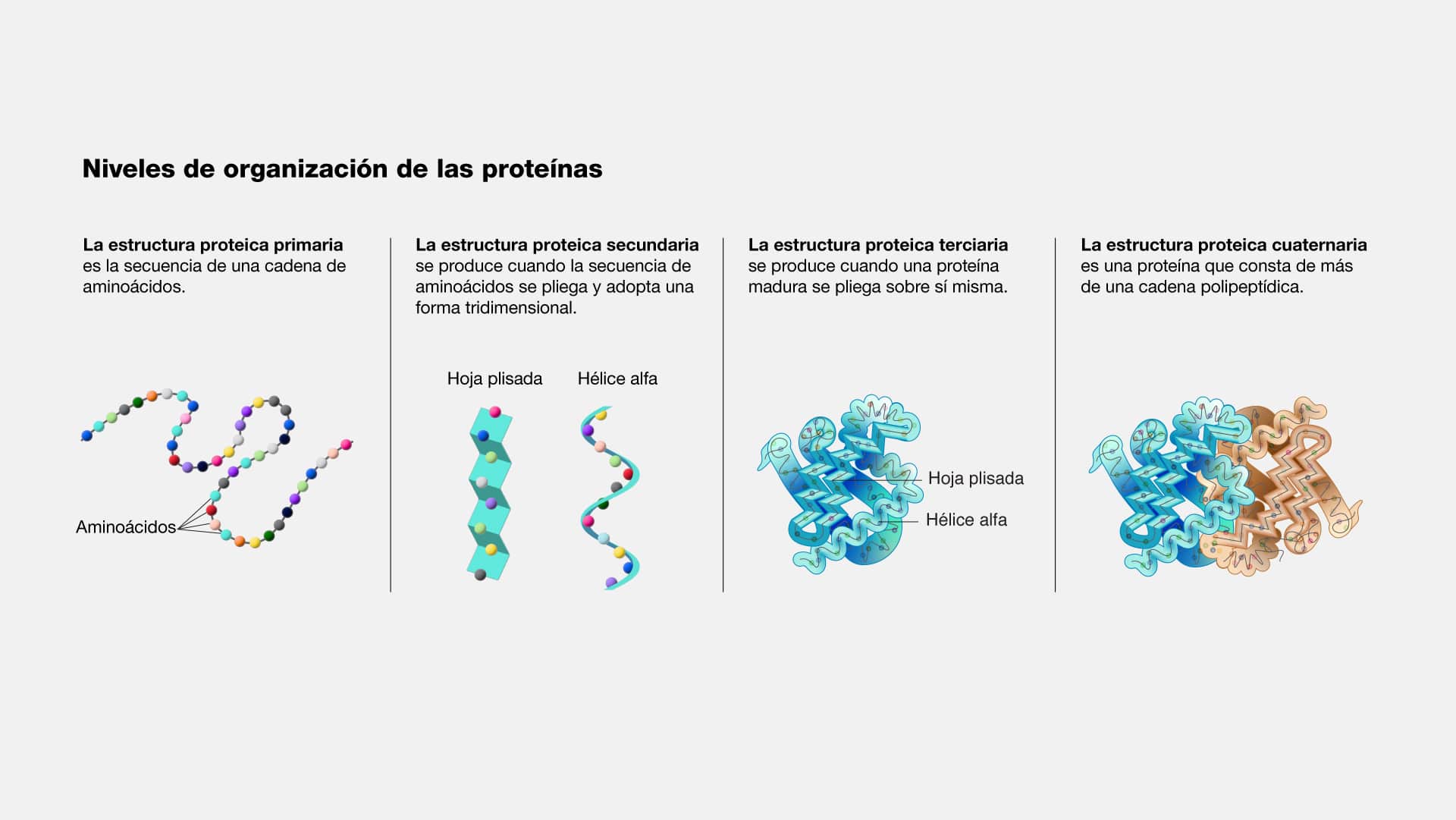

Proyecto genoma humano
Proyecto genoma humano
El Proyecto Genoma Humano fue una iniciativa internacional colosal que tuvo
como objetivo cartografiar y secuenciar cada uno de los aproximadamente
20,000-25,000 genes en el genoma humano. Este monumental esfuerzo científico,
que se lanzó en la década de 1990 y concluyó en 2023, abrió las puertas a una
nueva era de comprensión de nuestra biología.
El objetivo central del proyecto era determinar la secuencia exacta de las
letras químicas (A, C, G, T) que componen nuestro ADN, revelando así la
información genética fundamental. Sin embargo, no solo se trataba de contar genes,
sino de entender la variabilidad genética entre individuos. Este proyecto arrojó luz
sobre las similitudes y diferencias génicas que nos hacen únicos.
El conocimiento profundo del genoma humano ha permitido avances
significativos en la medicina personalizada. Ahora, los tratamientos pueden
adaptarse a la información genética única de un individuo. Además, con el genoma
humano mapeado, los científicos pueden explorar las raíces genéticas de
enfermedades complejas.
Este proyecto encontró dos curiosidades genómicas de gran interés. En
primer lugar, reflejó el porcentaje del ADN no codificante, que comprende alrededor
del 98% y se descubrió que una parte significativa está involucrada en la regulación y
control de los genes. Por otro lado, mostró conexiones genéticas inesperadas.
Algunos genes que se pensaba que estaban asociados con ciertas enfermedades
resultaron tener roles sorprendentes en otros procesos biológicos.

Pseudo gen
Pseudo gen
Los pseudogenes, como su nombre sugiere, son como "genes falsos". Aunque
comparten similitudes en secuencia con los genes activos, carecen de capacidad
funcional. Son, en esencia, restos genómicos de genes que en algún momento de la
evolución perdieron su función pero dejaron una huella intrigante en nuestro código
genético.
Es importante destacar que suelen acumular mutaciones a lo largo del tiempo,
desactivando las funciones que alguna vez tuvieron. Están en silencio, pero su
presencia revela una historia evolutiva fascinante. Distintas hipótesis apoyan
orígenes diversos, ya que pueden haber surgido de diferentes maneras, como la
duplicación de genes activos, la inserción de material genético viral o simplemente a
través de la pérdida gradual de su función original.
Los pseudogenes sirven como marcadores evolutivos, proporcionando pistas
sobre cómo han evolucionado los genes en el transcurso de la historia. Al
compararlos entre especies, los científicos pueden rastrear relaciones evolutivas y
descubrir cómo los genes han divergido o convergido a lo largo del tiempo. Por otro
lado, aunque inactivos, pueden influir en la expresión génica y tener implicaciones en
enfermedades, ofreciendo objetivos potenciales para la investigación médica.

R
Rasgo
Rasgo
En su esencia, un rasgo es una característica observable y medible de un
organismo, una manifestación visible o detectable de su patrimonio genético. Desde
la textura de la piel hasta la predisposición a ciertas enfermedades, los rasgos
ofrecen una ventana a la complejidad y la diversidad inherente a la vida misma.
Los rasgos pueden surgir de la influencia de los genes, los factores
ambientales o una interacción compleja entre ambos. Podemos observar una
diversidad de rasgos, que pueden clasificarse en cualitativos, como el color de los
ojos, o cuantitativos, como la estatura o la presión arterial.
Las aplicaciones de este conocimiento son vastas y profundas,
abarcando desde la agricultura hasta la medicina y más allá. En el campo de la
agricultura, los científicos y los agricultores han cultivado plantas con rasgos
deseables, mejorando los rendimientos y la resistencia a enfermedades. En la
medicina, los estudios genéticos han arrojado luz sobre las enfermedades
hereditarias, permitiendo diagnósticos tempranos y tratamientos personalizados.

Rasgo Poligenico
Rasgo Poligenico
Aunque a menudo pensamos en los rasgos como determinados por un solo
gen, muchos de ellos están influenciados por múltiples genes en lo que se conoce
como poligenia. A diferencia de los rasgos mendelianos simples, los poligénicos no
siguen un patrón hereditario de "dominante" o "recesivo". Más bien, la contribución
combinada de múltiples genes da como resultado una variación continua en la
expresión del rasgo.
Por ejemplo, la altura, el peso y la inteligencia son rasgos influenciados por la
interacción de múltiples genes y factores ambientales. La variación en el color de la
piel es otro claro ejemplo de un rasgo poligénico, donde diferentes genes influyen en
la producción y distribución de melanina, determinando la tonalidad de la piel.
La rama de la genética que estudia estos rasgos se denomina genética
cuantitativa. En el ámbito agrícola, muchos rasgos de interés, como el rendimiento de
los cultivos, la resistencia a enfermedades y la calidad del producto, están
influenciados por múltiples genes. Comprender la genética de estos rasgos ayuda a
los mejoradores de plantas a desarrollar variedades con características mejoradas
mediante la selección de individuos con marcadores genéticos favorables. En el
campo de la medicina y la salud humana, entender la genética cuantitativa de
enfermedades poligénicas como la diabetes, la hipertensión y la obesidad, contribuye
al diagnóstico temprano y al pronóstico y desarrollo de tratamientos personalizados.

Recesivo
Recesivo
En el escenario genético, los genes recesivos son aquellos cuyos efectos sólo
se manifiestan cuando dos copias idénticas de ese gen están presentes en el
individuo. En este baile genético, el recesivo espera en las sombras, mostrando su
influencia sólo cuando la pareja perfecta emerge.
Los genes recesivos son como actores enmascarados en una obra de teatro.
Cuando se encuentran en combinación con su versión dominante, esta última eclipsa
sus efectos. Solo en la intimidad de la doble presencia recesiva, se revela su poder.
Aunque pueden estar presentes en el ADN, su expresión fenotípica requiere dos
copias recesivas, una del padre y otra de la madre.
Un claro ejemplo de una patología recesiva es el albinismo, caracterizado por
la falta de pigmentación en la piel, el cabello y los ojos. Solo cuando ambos padres
son portadores del gen recesivo, el albinismo se manifiesta en la descendencia. Por
otro lado, encontramos la hemofilia, una condición sanguínea en la cual la
coagulación es deficiente. Esta enfermedad es causada por un gen recesivo ligado al
cromosoma X. Si una mujer es portadora, existe una probabilidad del 50% de que
transmita el gen mutado a su descendencia, tanto a hijos como a hijas. En el caso de
los hombres, al tener un solo cromosoma X, si heredan el gen mutado de su madre,
desarrollarán hemofilia.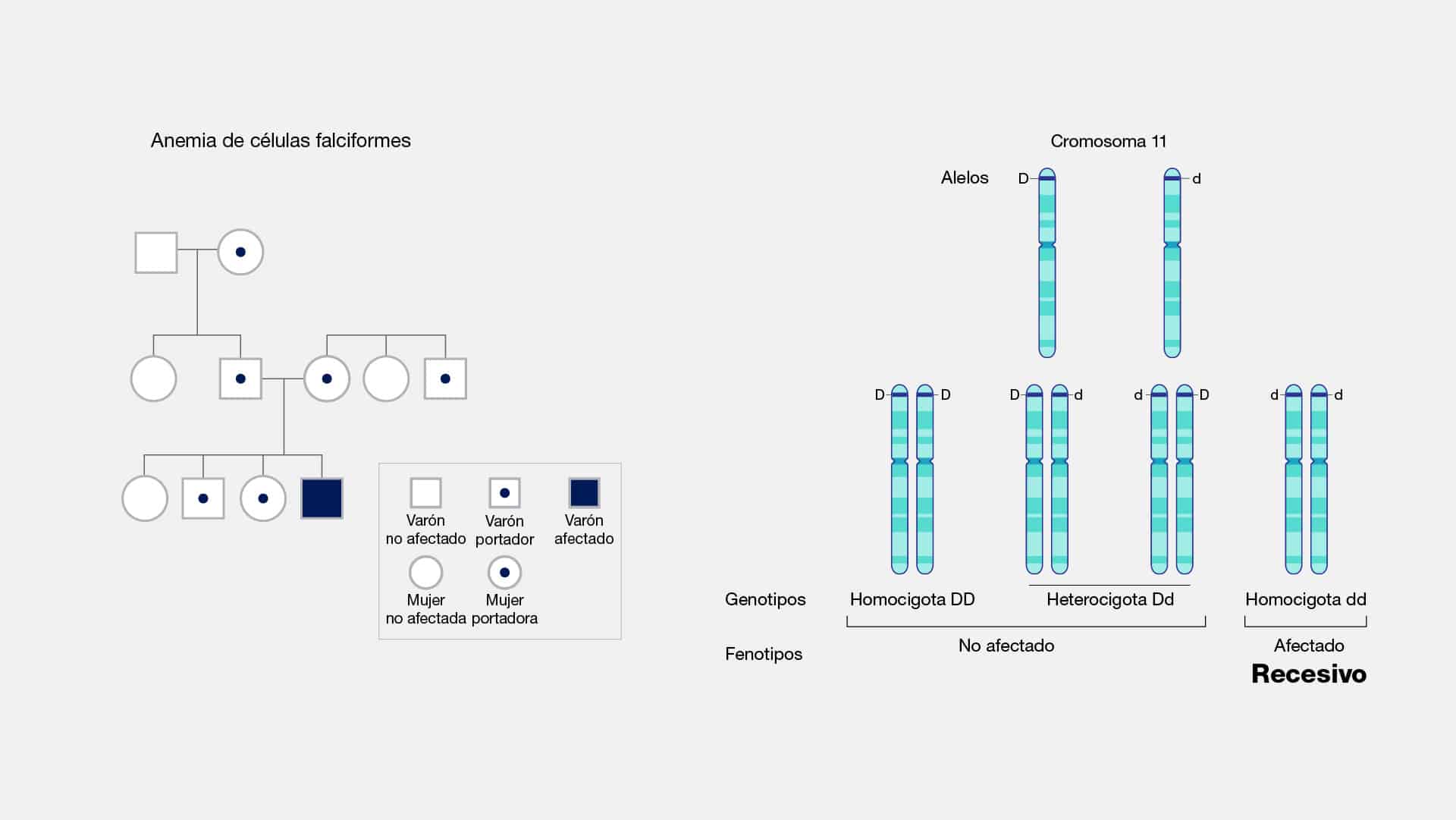

Recombinacion Homologa
Recombinacion Homologa
La recombinación homóloga es un ingenioso mecanismo que permite a los
organismos intercambiar fragmentos de ADN entre cromosomas homólogos durante
la división celular, una especie de juego de cartas cósmico donde los genes se
mezclan y reordenan para dar lugar a la diversidad genética. En la profase I de la
meiosis, las secuencias de ADN homólogas se alinean con una exquisitez casi
poética, permitiendo que los segmentos intercambiados sean virtualmente idénticos,
lo que minimiza los errores y garantiza una descendencia genéticamente saludable.
La recombinación homóloga no solo asegura la correcta segregación de los
cromosomas durante la división celular, sino que también es responsable de generar
esa fascinante diversidad genética que impulsa la evolución misma. A veces, puede
dar lugar a errores, como mutaciones que pueden tener consecuencias tanto
benignas como perjudiciales. Es un riesgo que la naturaleza acepta en su constante
búsqueda de la innovación y la adaptación.
En el mundo de la ingeniería genética, los científicos han aprendido a
aprovechar esta habilidad natural para introducir genes específicos en organismos.
Por ejemplo, en la agricultura, los cultivos transgénicos que resisten plagas o toleran
condiciones extremas son creados mediante esta técnica, promoviendo la seguridad
alimentaria y la sostenibilidad agrícola. Pero aquí no termina su versatilidad;
aplicando la recombinación homóloga se pueden corregir mutaciones específicas en
el ADN de las células, restaurando la función génica y ofreciendo esperanza a
pacientes con enfermedades devastadoras.

Regulacion genica
Regulacion genica
Imaginemos un director de orquesta que guía a cada músico para tocar en el
momento y tono precisos. La regulación génica es esa batuta maestra que controla
cómo y cuándo se expresan los genes en nuestras células, dando forma a la
identidad y funciones de cada una.
La regulación génica es altamente específica, con cada gen siendo regulado
de manera individual y precisa. También se caracteriza por ser dinámica y adaptable.
En un baile constante de señales moleculares y factores de transcripción, los genes
son activados o silenciados según las demandas del entorno celular o del organismo
en su conjunto. Es como un ballet coreografiado con maestría, donde los bailarines
se mueven al unísono pero también responden con flexibilidad a los cambios en la
música.
La regulación génica coordina la danza molecular durante el desarrollo
embrionario, asegurando que cada célula siga su destino específico en la formación
de tejidos y órganos. En el mundo de la medicina, su comprensión es la clave para
abordar enfermedades genéticas y diferentes tipos de cánceres. Los científicos
buscan descifrar cómo los genes son desregulados en estas condiciones
patológicas, con la esperanza de desarrollar terapias que restauren el equilibrio
perdido y devuelvan la salud al organismo enfermo.
Algunos genes tienen regiones llamadas "enhancers" que actúan como
interruptores de luz, activando o desactivando la expresión génica en respuesta a
señales específicas.

Repeticion en Tandem
Repeticion en Tandem
Imaginemos una secuencia genética donde ciertas cadenas de nucleótidos se
repiten una y otra vez, como un estribillo persistente en la sinfonía del código
genético. Básicamente, se trata de un fenómeno donde secuencias cortas de ADN se
duplican en tándem, creando patrones de repetición que danzan con gracia dentro
del genoma.
Su naturaleza repetitiva es clave, estas secuencias cortas se alinean una tras
otra, como cuentas en un collar, creando un patrón recurrente que puede variar en
longitud y composición. Esta variabilidad es un rasgo distintivo, una huella única que
permite la identificación de individuos y poblaciones, como una firma genética
grabada en la esencia misma de nuestro ser.
Estas secuencias repetidas se encuentran dispersas por todo el genoma,
desde los intrones que intervienen en la regulación génica hasta los telómeros que
protegen nuestros cromosomas. Sin embargo, es en las regiones codificantes donde
su presencia puede tener un impacto más notable, afectando la expresión de los
genes e incluso contribuyendo a la aparición de enfermedades genéticas.
Algunas repeticiones en tándem son conocidas como satélites y minisatélites.
Estos elementos genéticos cortos pero repetitivos crean estructuras fascinantes, a
menudo utilizadas en estudios de variabilidad genética y pruebas de paternidad.

Replicacion del ADN
Replicacion del ADN
La replicación del ADN es el intrincado ballet molecular que asegura la
perpetuación de la información genética de una célula a sus descendientes. Como
coreógrafo genético, este proceso garantiza la fidelidad y precisión en cada paso de
esta danza molecular, esencial para la continuidad de la vida.
En el centro de este escenario microscópico, la replicación comienza con la
separación de las hebras de ADN. En este delicado acto, las enzimas helicasas
desenrollan la doble hélice revelando las bases nitrogenadas. A continuación entran
en acción las enzimas ADN polimerasas, que actúan como obreros diligentes que
construyen nuevas cadenas de ADN siguiendo las instrucciones de las hebras
originales. Este proceso, realizado con gran precisión, garantiza que cada célula
nueva reciba la información genética sin cometer errores importantes. Los fallos en la
replicación, aunque raros, pueden tener consecuencias dramáticas, dando lugar a
mutaciones que podrían ser la chispa de la diversidad o, en ocasiones,
desencadenar condiciones patológicas.
La replicación del ADN no es solo una función biológica esencial, sino también
una herramienta invaluable en el ámbito científico y médico. En laboratorios, los
científicos han adoptado este proceso para amplificar segmentos específicos de
ADN, permitiendo la manipulación y estudio de genes con una precisión sin igual. La
técnica de la reacción en cadena de la polimerasa (PCR) es un claro ejemplo de
cómo la replicación del ADN ha trascendido su papel natural para convertirse en una
herramienta revolucionaria en la biotecnología.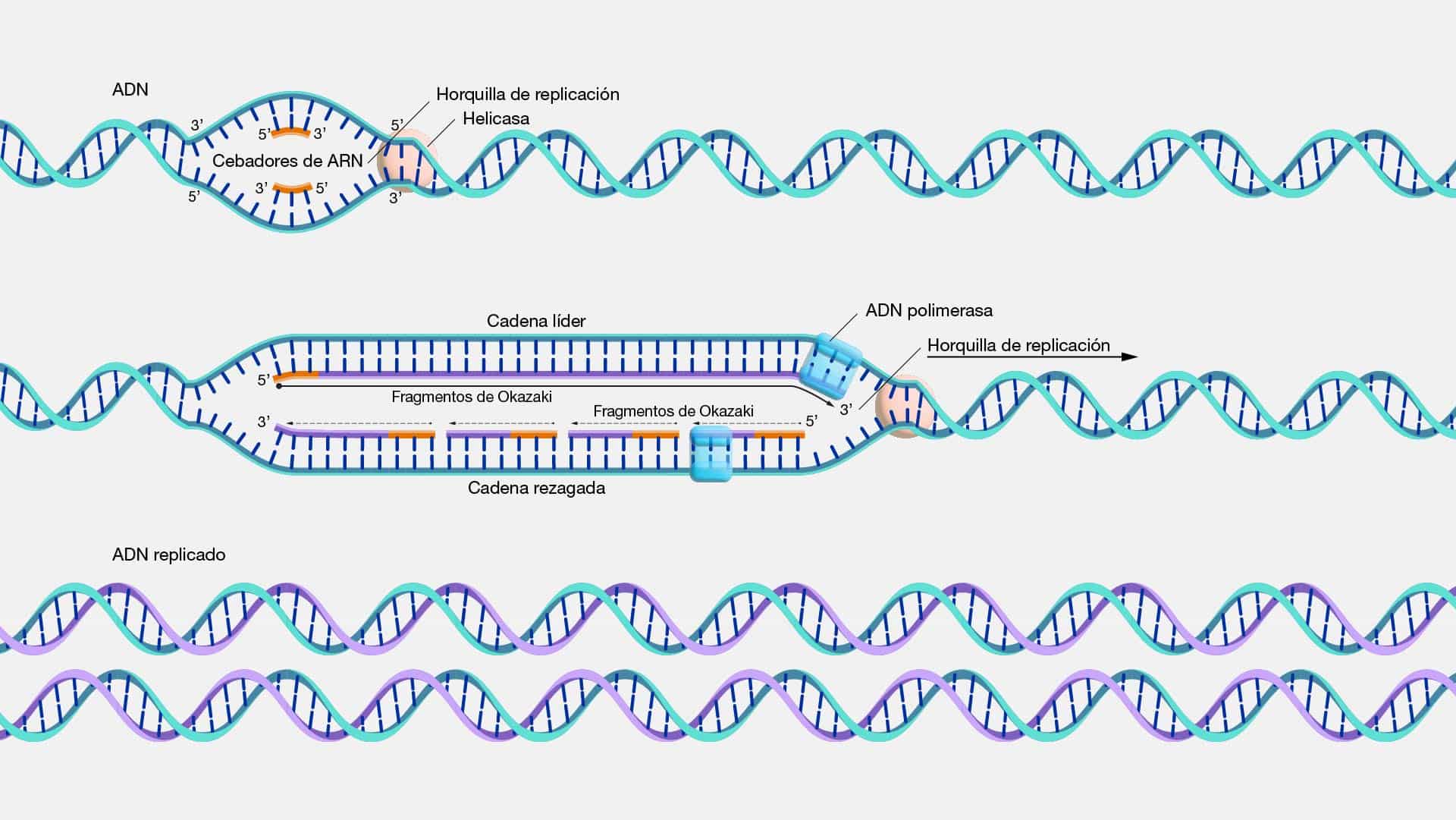

Represor
Represor
La represión genética es un sofisticado mecanismo de control que modula la
actividad de los genes en una célula u organismo. En esencia, implica la inhibición o
supresión de la expresión génica, evitando que ciertos genes produzcan proteínas o
ARNm en determinadas condiciones o momentos específicos.
Caracterizada por su precisión y sutileza, la represión genética desempeña un
papel crucial en la regulación de procesos biológicos fundamentales, como el
desarrollo embrionario, la diferenciación celular y la respuesta a estímulos
ambientales. Este intrincado sistema de control permite a los organismos ajustar su
comportamiento y adaptarse a cambios internos y externos de manera coordinada y
eficiente.
Un ejemplo a destacar es el fenómeno de la regulación transcripcional en
bacterias a través de operones. En estos sistemas, un represor se une al ADN cerca
del promotor de un gen específico, bloqueando así la transcripción y la síntesis de
proteínas. Solo cuando ciertas condiciones ambientales desencadenan la liberación
del represor, el gen puede expresarse y llevar a cabo su función biológica.
La represión genética ha sido aprovechada en aplicaciones tecnológicas
innovadoras. Por ejemplo, en la ingeniería genética, se utilizan represores sintéticos
para controlar la expresión de genes de interés en células y organismos modificados,
abriendo nuevas posibilidades en áreas como la biomedicina, la biotecnología y la
agricultura.

Ribosoma
Ribosoma
Pensemos en una fábrica minúscula y meticulosa dentro de cada célula,
donde las proteínas son producidas en una coreografía molecular precisa. Los
ribosomas son estas fábricas, estructuras compuestas de ARN ribosómico (ARNr)y
proteínas, que se encargan de traducir el código genético contenido en el ARN
mensajero (ARNm) en secuencias de aminoácidos.
A nivel estructural, los ribosomas constan de dos subunidades, una grande y
otra pequeña, que se ensamblan alrededor del ARNm durante el proceso de
traducción. Este montaje permite la perfecta lectura y decodificación del mensaje
genético. Su composición es en sí misma una mezcla armoniosa de ARN y
proteínas. El ARNr sirve como el armazón estructural, mientras que las proteínas
desempeñan funciones clave en el mantenimiento de la estabilidad y la precisión del
proceso de síntesis proteica.
A nivel funcional, su rol principal es llevar a cabo la traducción del código
genético, generando cadenas de aminoácidos que eventualmente se ensamblan en
proteínas funcionales. Los científicos han explorado la posibilidad de utilizar
ribosomas modificados para mejorar la eficiencia de la síntesis de proteínas durante
la terapia génica, donde se intenta corregir o reemplazar genes defectuosos.
En el contexto de la metagenómica, que se ocupa del estudio de comunidades
microbianas en su conjunto, los ribosomas sirven como marcadores moleculares
esenciales. Al analizar el ARNr presente en muestras ambientales, como suelos,
aguas o incluso el tracto digestivo humano, los científicos pueden inferir la diversidad
microbiana y comprender mejor la estructura y función de ecosistemas complejos.

Riesgo
Riesgo
El término "riesgo" es uno de esos conceptos que todos conocemos en la
superficie, pero que adquiere una nueva dimensión cuando lo exploramos en el
contexto de la genética. En esta disciplina fascinante, el riesgo no se trata solo de
una posibilidad abstracta, sino de la probabilidad concreta de que ocurra un evento
específico. En esencia, estamos investigando cómo la composición genética influye
en la probabilidad de expresión de un rasgo o característica.
El riesgo no es estático ni absoluto, puede variar según diversos factores,
desde la edad y el estilo de vida hasta la exposición ambiental. Es un terreno fértil
para la investigación, donde los científicos buscan comprender las complejas
interacciones entre nuestros genes y nuestro entorno para prevenir enfermedades y
promover la salud.

S
Secuenciacion del ADN
Secuenciacion del ADN
La secuenciación del ADN es el arte de leer, letra por letra, el alfabeto
genético que forma nuestro genoma. En términos sencillos, es desentrañar el texto
biológico que nos hace únicos. Esta herramienta ha evolucionado desde los primeros
días de la cadena de Sanger hasta las técnicas de nueva generación y, más
recientemente, la revolucionaria secuenciación de próxima generación (NGS, por sus
siglas en inglés). Esto ha permitido la decodificación de genomas enteros a
velocidades nunca antes imaginadas.
Caracterizada por su precisión milimétrica y su capacidad para revelar incluso
las más sutiles variaciones genéticas, la secuenciación del ADN es una herramienta
indispensable en la investigación científica y la medicina moderna. Nos permite no
solo identificar genes específicos asociados con enfermedades hereditarias, sino
también rastrear el origen y la evolución de poblaciones enteras a lo largo de
milenios.
En el ámbito de la medicina, ha revolucionado el diagnóstico y tratamiento de
enfermedades genéticas, permitiendo a los médicos personalizar la atención de
acuerdo con el perfil genético único de cada paciente. Por ejemplo, la secuenciación
del ADN tumoral puede proporcionar información crucial sobre las mutaciones
genéticas responsables del crecimiento descontrolado de las células cancerosas en
distintos tipos de cáncer, orientando así la elección de tratamientos más efectivos y
personalizados.
Por otro lado, la secuenciación de ADN antiguo ha permitido a los científicos
reconstruir genomas de especies extintas, como por ejemplo: los neandertales, y
rastrear la migración humana a lo largo de la historia.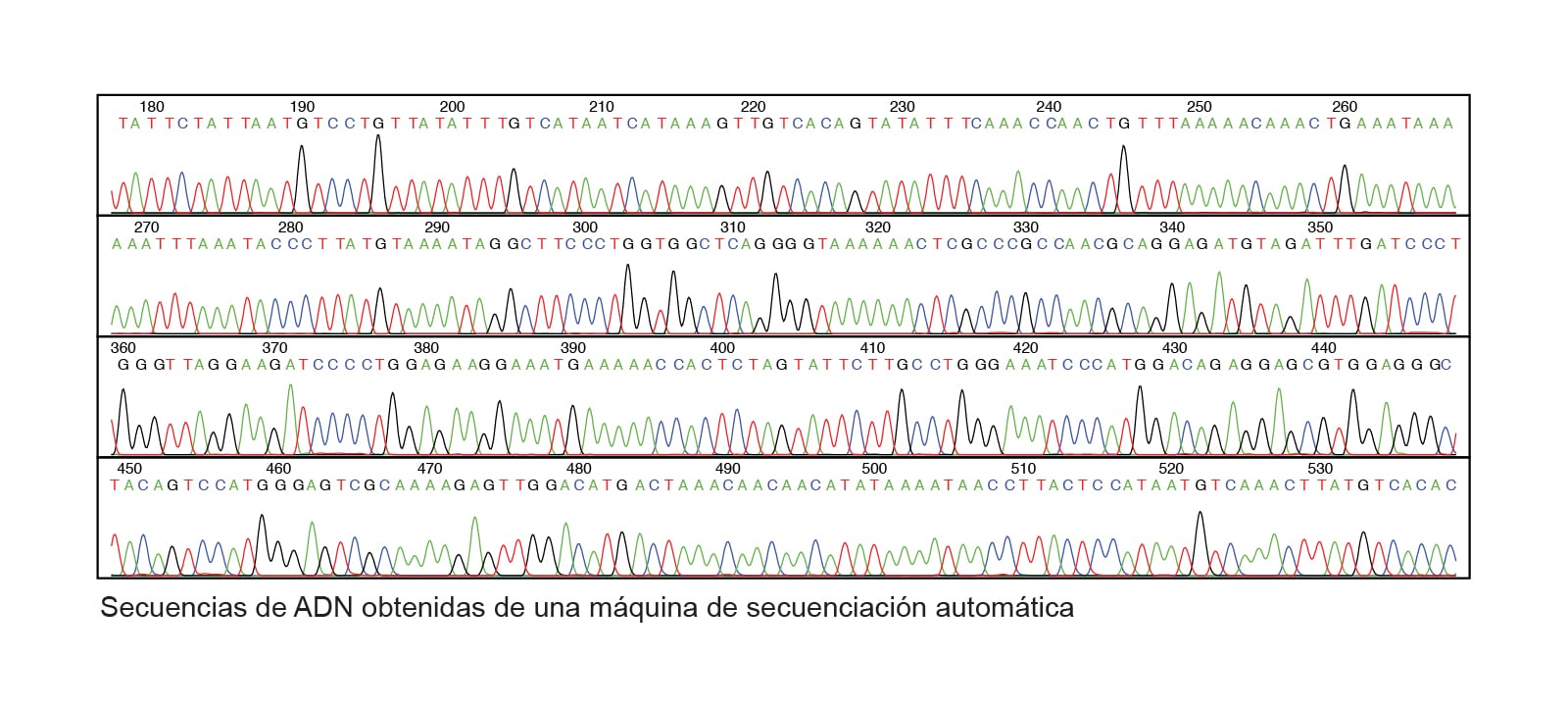

Sindrome
Sindrome
Pensemos en los síndromes como relatos clínicos, narraciones médicas que
describen un conjunto particular de síntomas y signos que ocurren juntos con cierta
frecuencia. Descifrar un síndrome a menudo es un juego de detectives médicos,
quienes deben interpretar estos datos, realizar pruebas y conectar los puntos para
revelar el diagnóstico subyacente.
Tomemos como ejemplo el Síndrome de Down, donde en lugar de las dos
copias habituales del cromosoma 21, hay una tercera copia; es decir, es una trisomía
que transforma la melodía genética. Por otro lado, podemos mencionar al Síndrome
del X frágil. En el núcleo de esta trama genética, encontramos una repetición
anormal del código genético en el gen FMR1 ubicado en el cromosoma X. Esta
expansión, que se asemeja a un delgado hilo, da origen a una condición que afecta
tanto a hombres como a mujeres, aunque con diferentes matices.
La citogenética es una herramienta invaluable en la detección y comprensión
de los síndromes genéticos, iluminando los rincones más oscuros del ADN humano y
ofreciendo esperanza para aquellos afectados por estas condiciones.

Southern Blot
Southern Blot
En el vasto escenario de la genética, donde las moléculas entrelazan su
danza cósmica, el Southern Blot emerge como un maestro de la detección exacta y
la separación meticulosa del ADN. Su fundamento se basa en el uso especial de
geles y sondas de ADN para desentrañar la presencia de fragmentos de este ácido
nucleico con una precisión casi quirúrgica.
Comienza con la extracción meticulosa del ADN de la muestra, seguida de su
separación por electroforesis en un gel. Luego, como un maestro de ceremonias, el
ADN se transfiere a una membrana de nitrocelulosa o nylon. En el clímax de esta
danza genética, llegamos a la fijación e hibridación, donde la membrana se convierte
en el lienzo para una sonda de ADN marcada, que busca y se une a su pareja
genética en un abrazo molecular. Finalmente, la detección de la sonda revela la
presencia de los fragmentos de ADN de interés, permitiendo que los científicos
cuantifiquen la muestra.
Esta técnica se ha convertido en un detective infalible, utilizado para estudiar
la estructura del ADN, analizar patrones de metilación, y explorar la presencia de
secuencias específicas asociadas a enfermedades genéticas.
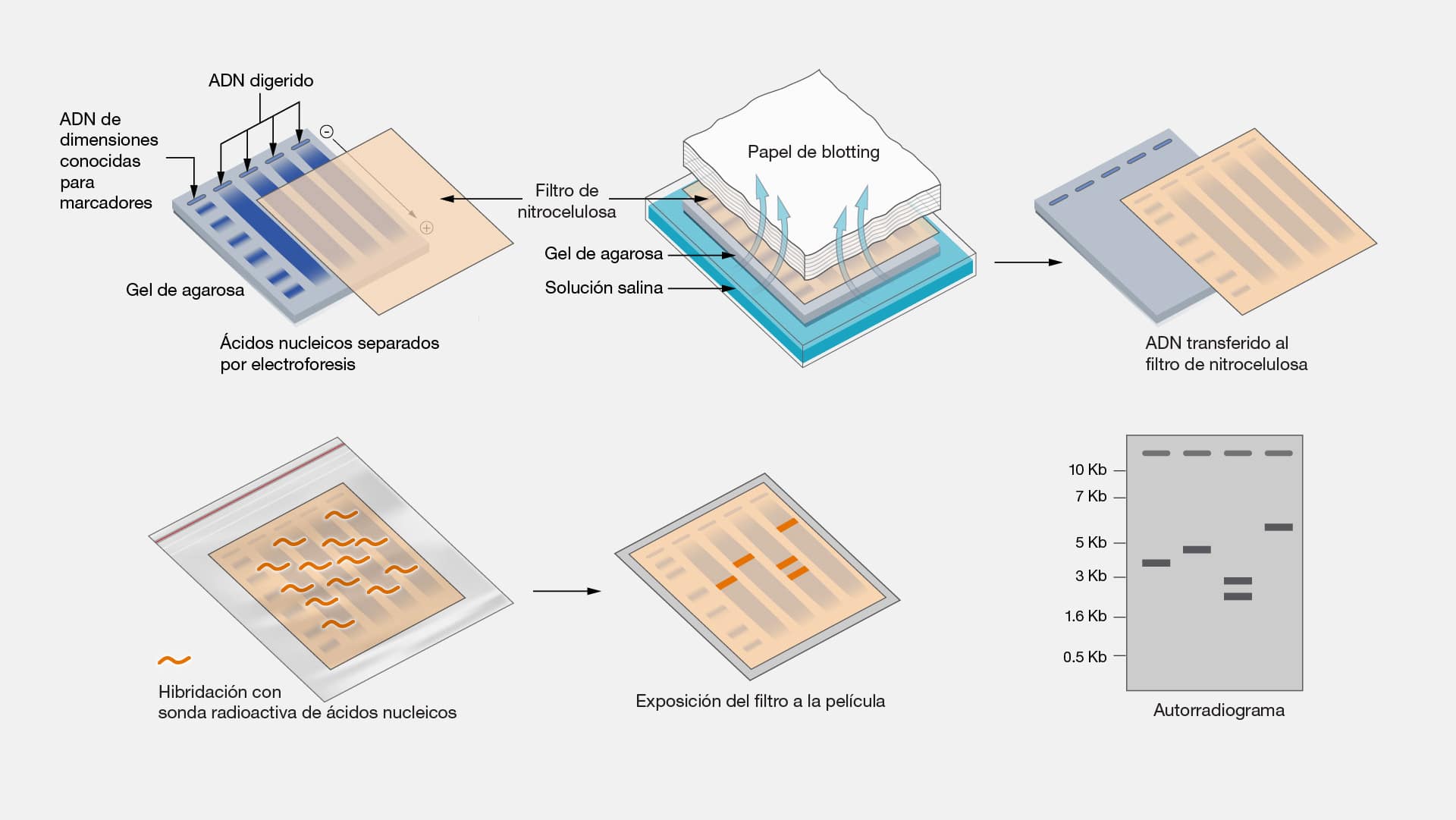

Susceptibilidad
Susceptibilidad
La susceptibilidad es la tendencia o predisposición que tiene un individuo para
responder de cierta manera frente a factores específicos del ambiente. Este baile
entre los genes y el entorno es como una coreografía única para cada uno de
nosotros, moldeando nuestras respuestas a estímulos externos. El medio, como el
director de orquesta, influye significativamente en cómo se expresa la
susceptibilidad. Desde factores nutricionales hasta exposiciones ambientales, estos
elementos desencadenan respuestas únicas en cada individuo.
La susceptibilidad se puede ejemplificar de diversas formas en la vida
cotidiana. Imaginemos a dos personas expuestas al mismo alérgeno, aquella con
una susceptibilidad genética específica puede experimentar una reacción más
intensa que la otra. Además, la susceptibilidad genética también juega un papel
crucial en enfermedades complejas como la diabetes o enfermedades
cardiovasculares. Algunos llevan genes que aumentan la probabilidad de desarrollar
estas condiciones, pero la expresión depende de la interacción con factores
ambientales.

Sustitucion
Sustitucion
La sustitución, en el contexto genético, es el reemplazo de una base
nitrogenada en la secuencia del ADN por otra. Estas bases, conocidas como adenina
(A), timina (T), citosina (C), y guanina (G), son los bloques de construcción de
nuestras instrucciones genéticas.
Las sustituciones pueden clasificarse en dos categorías principales. Las
transiciones ocurren cuando se reemplaza una purina (A o G) por otra, o una
pirimidina (T o C) por otra. Las transversiones, por otro lado, implican el cambio de
una purina por una pirimidina o viceversa.
En ocasiones, una sustitución puede no tener ningún impacto en la proteína
resultante, debido a la redundancia del código genético. Otras veces, puede dar lugar
a cambios significativos que afectan la estructura y función de la proteína. A lo largo
del tiempo, las sustituciones han sido las herramientas clave en el proceso de
evolución. Cambios en la secuencia genética permiten la adaptación a nuevos
entornos y desafíos.
Algunas sustituciones pueden ser responsables de enfermedades genéticas
hereditarias. Un solo cambio en la secuencia del ADN puede resultar en la
producción de proteínas defectuosas, dando lugar a condiciones como la fibrosis
quística o la anemia falciforme.

T
Tecnología de microarrays (chips de ADN o ARN)
Tecnología de microarrays (chips de ADN o ARN)
Los microarrays, también conocidos como chips de ADN o micromatrices, son
como alfombras mágicas que nos transportan al mundo minúsculo de los genes.
Estos ingenios tecnológicos consisten en pequeñas superficies cubiertas con miles
de diminutos fragmentos de ADN, cada uno diseñado para detectar un gen
específico.
En cuanto a su función, pueden analizar la expresión génica, es decir, cuándo
y en qué cantidad se activan o desactivan los genes en diferentes condiciones. Sin
embargo, la verdadera maravilla radica en su capacidad para analizar miles de genes
simultáneamente. Es como si cada punto en estos chips contara una historia única,
revelando los secretos de nuestro ADN.
Los científicos lo utilizan para investigar enfermedades, analizando patrones
de expresión génica en tejidos enfermos y comparándolos con los tejidos sanos. Esto
ayuda a identificar genes involucrados en condiciones como el cáncer o
enfermedades genéticas. Mientras que en el ámbito de la farmacogenómica,
permiten estudiar cómo diferentes individuos responden a los medicamentos en
función de sus perfiles genéticos; abriendo la puerta a tratamientos más efectivos y
personalizados.

Telomero
Telomero
Los telómeros son como los custodios del enigma genético. En su esencia,
son secuencias repetitivas de ADN presentes en los extremos de nuestros
cromosomas, como las puntas de los cordones en los zapatos que evitan que éstos
se deshagan. Su principal función es evitar que los cromosomas se acorten durante
cada división celular y así proteger la información genética esencial.
Cada vez que nuestras células se dividen, los telómeros se acortan un poco.
Cuando se vuelven demasiado cortos, las células dejan de dividirse, marcando su
propio reloj biológico. Para contrarrestar este acortamiento, entra en escena la
telomerasa, una enzima única, que alarga los telómeros, brindando a nuestras
células una coreografía molecular que desafía a la vejez y permite una replicación
continua. Estudiar cómo los telómeros se comportan con el tiempo proporciona
claves valiosas sobre el proceso de envejecimiento y las enfermedades asociadas.
¿Sabías que el estrés puede afectar la longitud de los telómeros?
Investigaciones sugieren que altos niveles de estrés pueden acelerar el acortamiento
telomérico; un recordatorio de que nuestras experiencias emocionales están
entrelazadas con nuestra biología más profunda.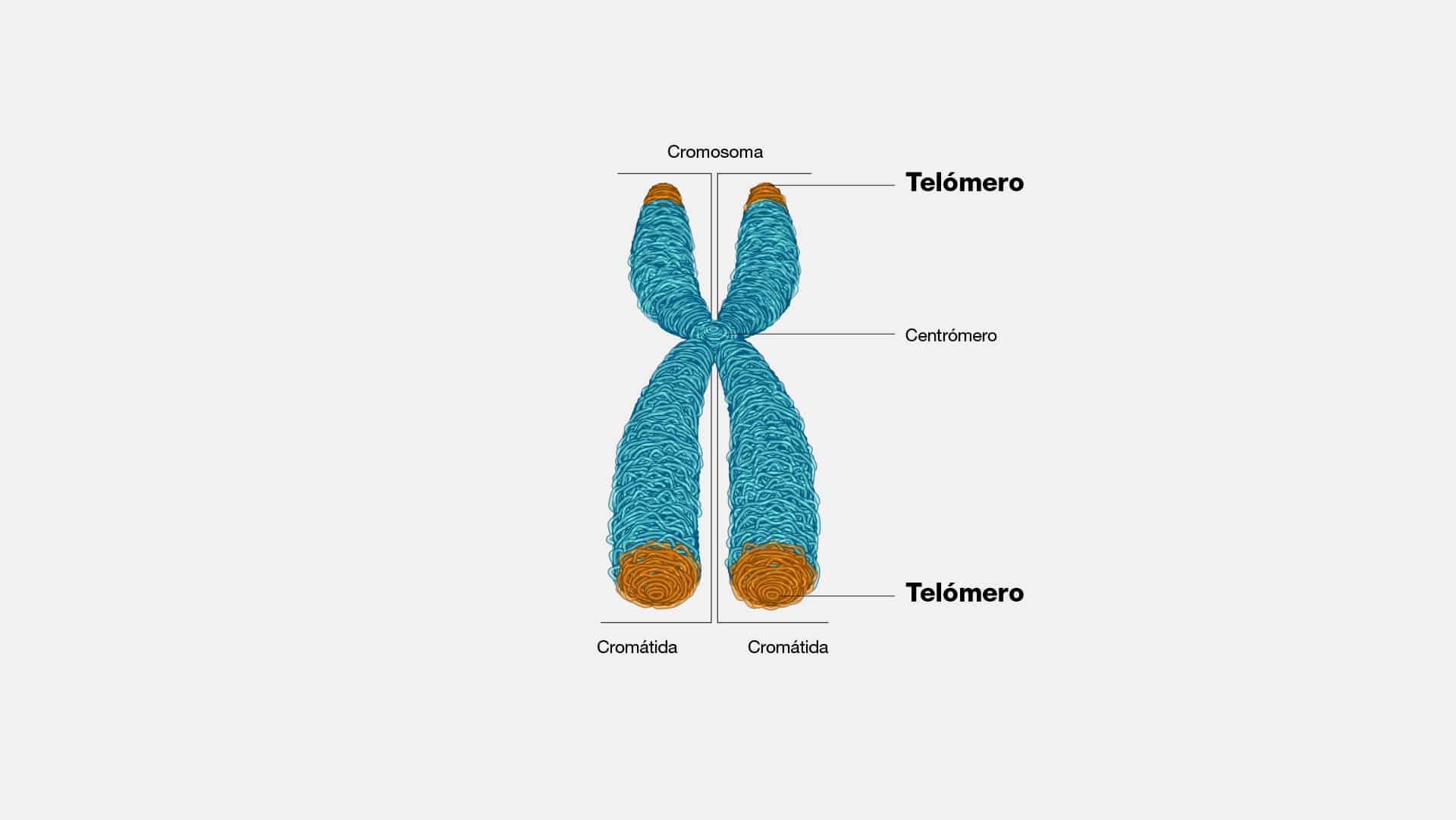

Terapia Genica
Terapia Genica
La terapia génica es una suerte de "edición maestra del genoma", donde los
científicos pueden intervenir en el código genético, reparando defectos y
armonizando la expresión génica. En su esencia, implica la introducción de material
genético en las células de un individuo para corregir o reemplazar genes
defectuosos, abriendo así nuevas posibilidades para el tratamiento de enfermedades
hereditarias, cáncer y trastornos génicos adquiridos. Para llevar a cabo esta
intervención, se utilizan vectores, como los virus modificados, que actúan como
mensajeros intracelulares.
Los ejemplos de aplicación de la terapia génica nos sumergen en un mar de
posibilidades terapéuticas. En las enfermedades como la fibrosis quística, donde un
solo gen defectuoso condena a los pacientes a una vida de dificultad respiratoria, la
terapia génica ofrece la esperanza de una cura duradera al reemplazar el gen
defectuoso con uno funcional. Del mismo modo, en trastornos sanguíneos como la
anemia de células falciformes, puede ofrecer una solución definitiva al corregir la
mutación en las células madre hematopoyéticas.

Timina
Timina
En el maravilloso escenario del ADN, donde las letras del alfabeto genético
danzan en una coreografía de vida, la timina (T) emerge como una destacada
protagonista. Es una de las cuatro bases nitrogenadas que componen los escalones
de la doble hélice del ADN, junto con la adenina (A), la citosina (C) y la guanina (G).
Esta delicada molécula, con su estructura de anillo de pirimidina, se entrelaza con su
pareja complementaria, la adenina, en un abrazo químico que sostiene la esencia
misma de la vida.
Un dato curioso al respecto de esta base es que es sensible a la luz
ultravioleta. Cuando la piel está expuesta a esta luz, puede causar daño a las
moléculas de timina, lo que lleva a problemas de salud, principalmente, al desarrollo
de enfermedades cutáneas como el cáncer de piel. Sin embargo, esta misma
capacidad de absorción de la timina se aprovecha en aplicaciones como la
fototerapia, donde la luz ultravioleta se utiliza para tratar afecciones dermatológicas
como la psoriasis.
¿Sabías que el ARN no tiene timina? En su lugar, utiliza otra base nitrogenada
denominada uracilo que también tiene una estructura de anillo de pirimidina y se
entrelaza con la adenina formando su pareja complementaria.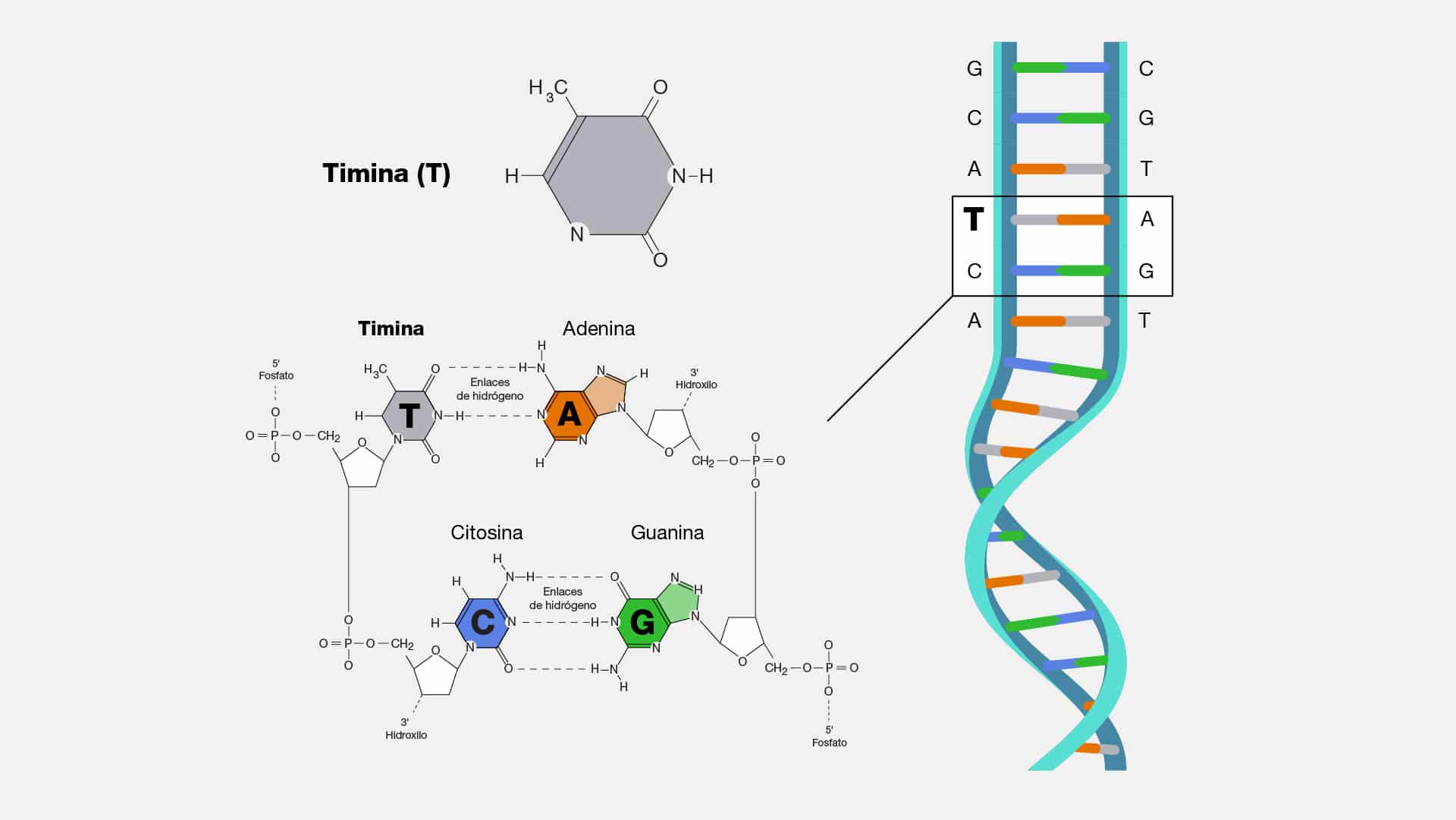

Traduccion
Traduccion
Imaginemos una fábrica de palabras, donde ribosomas actúan como hábiles
traductores, interpretando el código genético y ensamblando aminoácidos en
complejas cadenas de proteínas. Este proceso es meticuloso y altamente regulado,
donde cada palabra y coma en el código genético se traduce con exactitud
milimétrica.
La traducción biológica es un ballet de precisión molecular, donde los
ribosomas se deslizan a lo largo del ARNm y siguiendo sus instrucciones, los ARNt
entregan los aminoácidos en el orden correcto, formando así una cadena peptídica
que se pliega y se convierte en una proteína funcional. Es un proceso dinámico,
donde múltiples factores, como los de iniciación y elongación, trabajan en armonía
para asegurar la exactitud y eficiencia. Una característica fascinante de la síntesis de
proteínas es su universalidad. Aunque los idiomas del ADN pueden variar entre
especies, el proceso de traducción sigue siendo fundamentalmente similar en todos
los organismos vivos.
En el ámbito de la aplicación práctica, tiene numerosas aplicaciones. Por
ejemplo, comprender cómo los errores en la traducción pueden conducir a
enfermedades genéticas como la distrofia muscular de Duchenne o la fibrosis
quística ha llevado al desarrollo de terapias génicas y tratamientos farmacológicos
innovadores. Además, la ingeniería de proteínas, donde se modifican secuencias de
aminoácidos para mejorar las propiedades de estas macromoléculas, es una área de
investigación en rápido crecimiento con aplicaciones en medicina, biotecnología y
más allá.

Transcripcion
Transcripcion
Imaginemos un proceso sutil, donde una copia fiel del ADN es escrita en un
nuevo dialecto molecular llamado ARN. La transcripción es un proceso altamente
regulado y preciso, donde cada letra del código genético es transcrita con una
exactitud casi poética. Además, es dinámica y adaptable, respondiendo a las
necesidades cambiantes de la célula y del organismo en su conjunto. Este proceso
es vital, ya que permite que la información codificada en el ADN pueda salir del
núcleo celular al citoplasma.
En este intrincado ballet molecular, en el que las enzimas y proteínas
desempeñan roles clave, el ADN actúa como el guión maestro que dirige la síntesis
del ARNm. Luego, entra en escena el splicing, una suerte de director de edición que
modifica el ARNm, eliminando los intrones no codificantes y uniendo los exones para
formar un mensaje genético coherente. Este proceso de "corte y empalme" permite la
creación de una versión funcional del ARNm que será la partitura para la producción
de proteínas.
En el amplio campo de la biología, la transcripción despliega su influencia en
innumerables aspectos de la vida. Por ejemplo, en el desarrollo embrionario, actúa
como el director de orquesta que coordina la expresión génica para dar forma y
función a cada tejido y órgano del organismo en desarrollo. En la respuesta inmune,
permite a las células combatir invasores patógenos al producir proteínas
especializadas que neutralizan amenazas externas.
La transcripción no solo se limita solamente a organismos vivos. En el ámbito
de la biología sintética, los científicos han desarrollado sistemas de transcripción
artificial para programar células con funciones específicas, abriendo la puerta a una
nueva era de ingeniería biológica donde solo la imaginación establece los límites.

Transgenico
Transgenico
Un transgénico es el resultado de introducir genes de una especie en el
genoma de otra, creando así organismos modificados genéticamente (OMG). Es
como si la biotecnología tomara las riendas de la evolución, mezclando las cartas del
ADN para obtener nuevas combinaciones.
Caracterizados por su versatilidad y capacidad de adaptación, los
transgénicos han encontrado aplicación en una amplia gama de campos. En el
ámbito agrícola, por ejemplo, se han desarrollado cultivos transgénicos resistentes a
herbicidas y plagas, reduciendo la necesidad de pesticidas y promoviendo prácticas
agrícolas más sostenibles y amigables con el medio ambiente. Sin embargo, no se
limitan a este ámbito; también han incursionado en la esfera médica, donde han
abierto nuevas puertas hacia terapias innovadoras y tratamientos personalizados.
Desde la producción de medicamentos biotecnológicos hasta la ingeniería de células
y tejidos para terapias génicas.
Detrás de la fascinación por su potencial, los transgénicos también han
suscitado debates éticos y preocupaciones sobre su impacto en la salud humana y el
medio ambiente. En última instancia, nos invitan a reflexionar sobre el poder y la
responsabilidad que conlleva la manipulación genética. Son una herramienta
poderosa que, utilizada de manera responsable y ética, puede abrir nuevas fronteras
en la ciencia y la tecnología.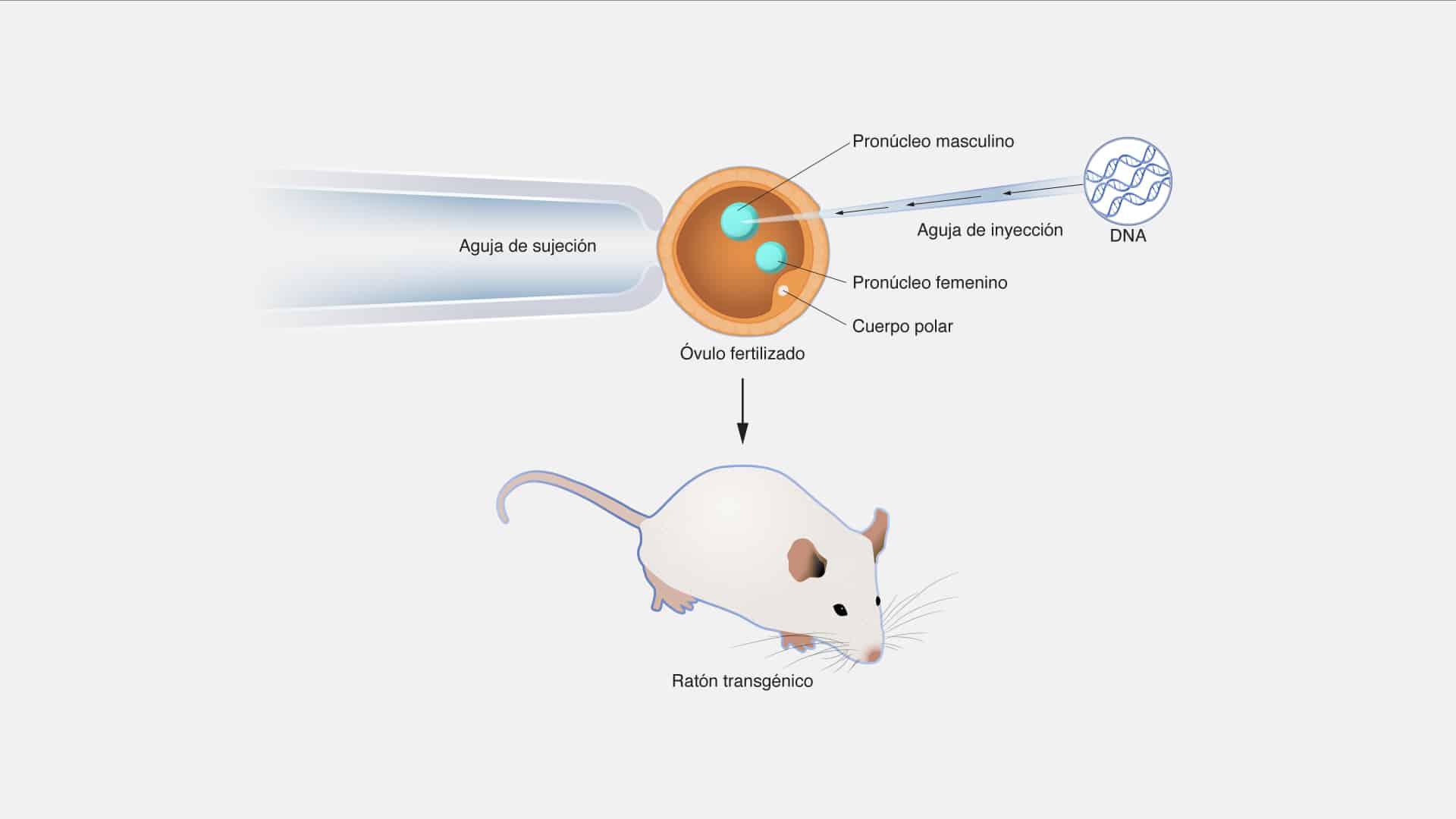

Translocacion
Translocacion
Las translocaciones cromosómicas son actos de malabarismo genético donde
fragmentos de cromosomas se rompen y se unen a otros, generando nuevas
combinaciones génicas. Este intrigante fenómeno puede ocurrir tanto en células
somáticas como en células reproductoras, y su impacto puede ser una sinfonía
genética o un desafío para la salud.
A diferencia de la herencia genética típica, donde los genes se transmiten de
padres a hijos sin cambios, las translocaciones cromosómicas alteran el mapa
génico. Estos reordenamientos pueden ser recíprocos, donde dos cromosomas
intercambian fragmentos de manera equitativa, o desbalanceados, donde un
cromosoma cede más material genético que el otro.
Las translocaciones pueden ocurrir entre cromosomas no homólogos o entre
homólogos, añadiendo una capa adicional de complejidad y misterio. Cuando
involucran cromosomas homólogos, pueden resultar en una translocación
balanceada, fomentando la variabilidad genética y la evolución al generar nuevas
combinaciones y contribuir a la diversificación de las poblaciones con el tiempo.
En algunos casos, como en ciertos tipos de cáncer, las translocaciones
cromosómicas pueden conducir a la fusión de genes, dando lugar a proteínas
alteradas que contribuyen al desarrollo de la enfermedad. Por ejemplo, en la
leucemia mieloide crónica, se produce una translocación específica entre los
cromosomas 9 y 22, creando el cromosoma Filadelfia, que impulsa la proliferación
descontrolada de células cancerosas.
La translocación robertsoniana es un tipo específico de translocación
cromosómica en la que dos cromosomas acrocéntricos, generalmente los
cromosomas 13, 14, 15, 21 o 22, se fusionan en una sola estructura cromosómica.
Este fenómeno resulta en la pérdida de los brazos cortos de los cromosomas
involucrados y en la formación de un cromosoma metacéntrico más grande.

U
Uracilo
Uracilo
El uracilo (U) es una de las cuatro bases nitrogenadas que conforman el ácido
ribonucleico (ARN), junto con la adenina (A), citosina (C) y guanina (G). Este
nucleótido, fundamental en la estructura del ARN, desempeña un papel crucial en la
transcripción de la información genética y en el transporte de estas instrucciones
desde el ADN hasta la maquinaria celular.
En el ARN, el uracilo toma el centro del escenario como el homólogo del
timina (T) en el ADN, asociándose con la adenina durante el proceso de
transcripción. Es decir, cada vez que la enzima ARN polimerasa sintetiza una cadena
de ARN a partir de una hebra de ADN, la timina se transcribe como uracilo.
Aunque vital, el uracilo es menos estable que la timina, lo que puede hacerlo
más propenso a la degradación y añadir un grado de vulnerabilidad a su función en
los procesos celulares. Esta diferencia en estabilidad tiene implicaciones importantes
en la regulación y la precisión de la expresión génica.

V
Variabilidad genica
Variabilidad genica
La variabilidad genética es el teatro de la diversidad en el ADN de una
población. Se refiere a las diferencias en los genes y las secuencias genéticas entre
los individuos de una especie. Es el ingrediente clave que confiere singularidad a
cada ser vivo y permite la evolución de las especies a lo largo del tiempo.
Cada individuo hereda los alelos de sus padres, y la combinación única de
estos contribuye a las diferencias genéticas entre los seres vivos. Por otro lado, la
reproducción sexual y las mutaciones introducen continuamente variaciones
genéticas, asegurando que cada generación sea única.
La variabilidad genética es la clave de la adaptabilidad de las especies.
Imaginemos, por ejemplo, un escenario donde una población de bacterias enfrenta
un nuevo antibiótico. Aquellas con mutaciones que les confieren resistencia
sobreviven y pasan sus 'trucos genéticos' a las generaciones futuras.

Variacion e numero de copias
Variacion e numero de copias
En el vasto tapiz de la genética, donde cada gen es como un hilo que teje una
narrativa única, la Variación en el Número de Copias (VCN) emerge como un
intrigante capítulo que despierta nuestra curiosidad y asombro. La VCN es un
fenómeno genómico que implica la presencia de más de una copia de ciertos
segmentos de ADN en el genoma de un organismo. Estas duplicaciones,
triplicaciones o incluso más, pueden surgir de diversas formas, desde eventos de
duplicación génica hasta la pérdida de control en la regulación de la copia de genes
específicos, influenciando así la función génica y las características del individuo.
En el ámbito de la aplicación práctica, ha abierto las puertas a un vasto
territorio de investigación y descubrimiento. Por ejemplo, en el campo de la medicina
personalizada, la detección de variaciones en el número de copias puede
proporcionar información invaluable para el diagnóstico y tratamiento de
enfermedades genéticas, como el síndrome de Williams-Beuren o la esquizofrenia,
entre otras condiciones. Además, la VCN ha revelado su papel crucial en la evolución
y diversificación de las especies. Eventos de duplicación génica pueden generar
nuevos genes con funciones novedosas, impulsando la innovación genómica y la
adaptación a entornos cambiantes a lo largo de millones de años.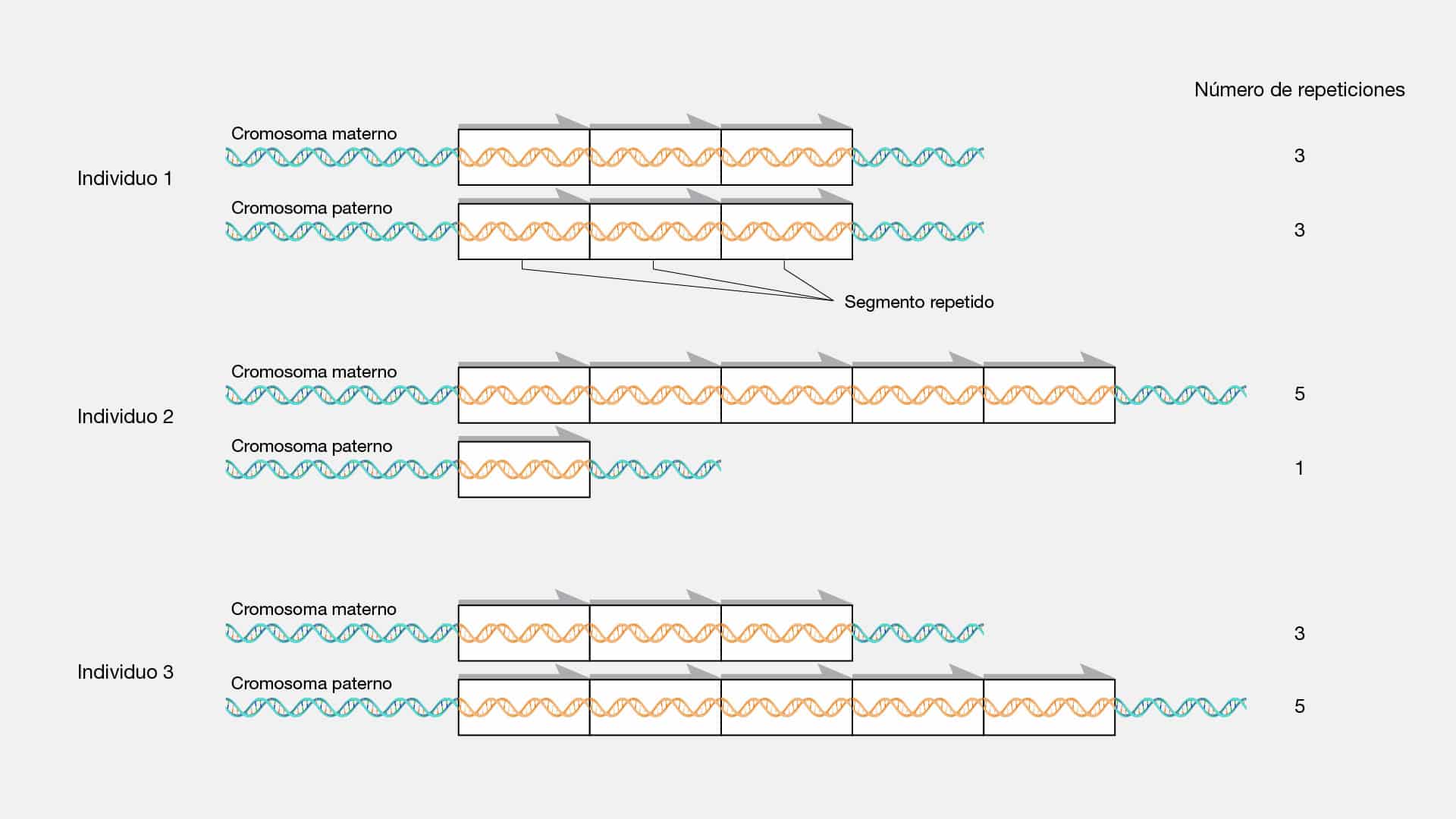

Vector
Vector
Imaginemos al vector como un mensajero genético, el portador de información
invaluable que viaja a través de los dominios celulares para entregar su carga
génica. En términos sencillos, es el vehículo que transporta y entrega genes, como
un correo de la evolución moderna.
Los vectores vienen en diferentes formas y tamaños, desde virus modificados
hasta plásmidos bacterianos. Esta diversidad permite a los científicos elegir el vector
perfecto para la tarea en cuestión. Su principal función es transportar genes
específicos y entregarlos a células objetivo. Para ello, suelen ser diseñados para
expresar genes, corregir mutaciones o incluso introducir genes foráneos en
organismos.
En el campo de la biotecnología, los vectores encuentran una amplia gama de
aplicaciones. Por ejemplo, en la terapia génica, los vectores virales son utilizados
para entregar genes correctivos a las células defectuosas, ofreciendo una promesa
de cura para enfermedades genéticas devastadoras. También se emplean en la
ingeniería genética de cultivos agrícolas, donde los vectores plasmídicos son
utilizados para introducir genes de interés, como la resistencia a plagas o la
tolerancia a condiciones ambientales adversas.

Términos Más Consultados
- Acido desoxirribonucleico (ADN)
- Acido nucleico
- Locus
- Acido ribonucleico (ARN)
- Adenina
- Efecto fundador
- Antisentido
- Alelo
- ARN mensajero (ARNm)
- Giemsa
Las imágenes son cortesía del "National Human Genome Research Institute" y editadas por CROM

